
| 熔 点 | 沸 点 | 热 稳 定 性 | 与 碱 反 应 |
| 101℃~102℃ | 150℃~160℃ 升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |
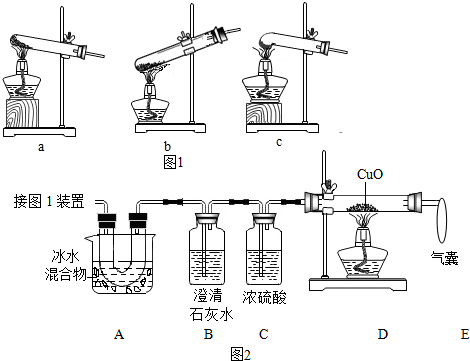
分析 (1)根据草酸晶体的熔点较低,受热容易熔化进行解答;
(2)①根据除去草酸蒸气,防止对二氧化碳的检验产生干扰进行解答;
②根据一氧化碳有毒,污染空气解答;
③根据二氧化碳能使澄清的石灰水变浑浊进行解答;
④根据一氧化碳的还原性可以进行相关方面的判断;
(3)一氧化碳部分反应,生成的铜重新被氧化等因素都能够导致计算出的实验结果比实际值偏低;
(4)根据高锰酸钾的质量求出样品中草酸的质量,进而求出晶体的质量以及样品中草酸晶体(H2C2O4•2H2O )的质量分数即可.
解答 解:(1)草酸的熔点较低,受热容易熔化,用c装置加热草酸时不容易下流,适宜用来加热草酸;
(2)①A的作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰;
②因为一氧化碳有毒,污染空气,气囊的作用是收集未反应的一氧化碳,防止空气污染;
③二氧化碳能使澄清的石灰水变浑浊,证明存在CO2的现象是:澄清的石灰水变浑浊,二氧化碳和石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
④证明存在CO的现象是:D中黑色固体变成红色.
(3)一氧化碳部分反应,生成的铜重新被氧化等因素都能够导致计算出的实验结果比实际值偏低;
(4)设草酸晶体的质量为x.
由2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可知,
5H2C2O4•2H2O→5H2C2O4→2KMnO4
630 316
x 7.9g
$\frac{630}{x}=\frac{316}{7.9g}$
x=15.75g
样品中草酸晶体(H2C2O4•2H2O )的质量分数=$\frac{15.75g}{17.5g}×100%$=90%
答:样品中草酸晶体(H2C2O4•2H2O )的质量分数为90%.
故答案为:
(1)c;
(2)①除去草酸蒸气,防止对二氧化碳的检验产生干扰;
②收集未反应的一氧化碳,防止空气污染;
③B装置内的澄清石灰水变浑浊;CO2+Ca(OH)2═CaCO3↓+H2O;
④D装置中黑色固体变红;
(3)一氧化碳没有全部与氧化铜反应;
(4)90%.
点评 本题涉及化学方程式的书写、实验现象的判断、根据化学方程式进行计算等方面的知识,是典型的综合题.


科目:初中化学 来源: 题型:选择题
| A. | 生石灰可用来干燥过氧化氢溶液(又称双氧水)制得的氧气 | |
| B. | 打开浓盐酸的瓶盖,见到瓶口出现白雾现象 | |
| C. | 氢氧化钠不能用来治疗胃酸过多症 | |
| D. | 紫色石蕊遇到稀酸变为红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度较快 |
| 结论 | 锰的金属活泼性大于铁. | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
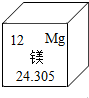 元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )
元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )| A. | 原子序数是12 | B. | 它是金属元素 | ||
| C. | 原子结构示意图为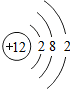 | D. | 镁的相对原子质量是24.305 g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
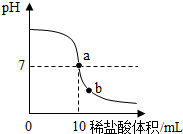 在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法:
在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
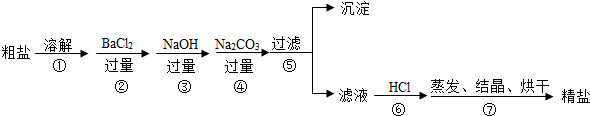
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 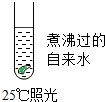 | B. | 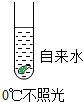 | C. | 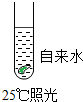 | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com