
 ×100%,所以要使溶质的质量分数增大,可增加溶质的质量或减少溶剂的质量.
×100%,所以要使溶质的质量分数增大,可增加溶质的质量或减少溶剂的质量.

科目:初中化学 来源: 题型:阅读理解
| OH- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
| 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥88% 钙(以Ca计)(0.5-1.3)% 碘(以I计)(20-50)mg/kg |
查看答案和解析>>
科目:初中化学 来源: 题型:
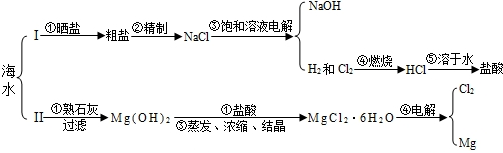
 (2011?南京)某化学兴趣小组进行溶液的配置和粗盐的初步提纯实验.
(2011?南京)某化学兴趣小组进行溶液的配置和粗盐的初步提纯实验.查看答案和解析>>
科目:初中化学 来源: 题型:
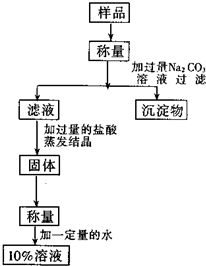 用含有少量氯化钙的氯化钠固体配置溶质的质量分数为10%的氯化钠溶液,设计如图所示操作方案.请回答:
用含有少量氯化钙的氯化钠固体配置溶质的质量分数为10%的氯化钠溶液,设计如图所示操作方案.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?长宁区一模)某化学兴趣小组欲进行粗盐的初步提纯和溶液的配制实验.
(2013?长宁区一模)某化学兴趣小组欲进行粗盐的初步提纯和溶液的配制实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com