
分析 (1)随着反应的不断进行,硫酸的浓度越来越小;
(2)硫酸和反应生成的硫酸铜都能够和氯化钡反应生成硫酸钡沉淀;
(3)不同的实验装置,功能不同;
气体压强随着气体分子的增多而增大;
(4)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
锌和稀硫酸反应生成硫酸锌和氢气,和硫酸铜反应生成硫酸锌和铜;
温度越高,气体体积越大,温度越低,气体体积越小;
如果操作不当,会影响实验结果.
解答 解:(1)铜与浓硫酸反应中即使铜过量也不能将硫酸完全反应的原因是:随着反应的进行,浓硫酸浓度下降变成稀硫酸,而铜与稀硫酸不反应.
故填:随着反应的进行,浓硫酸浓度下降变成稀硫酸,而铜与稀硫酸不反应.
(2)甲方案不可行,这是因为残余清液中的硫酸铜也能和氯化钡反应生成硫酸钡沉淀.
故填:不可行;残余清液中的硫酸铜也能和氯化钡反应生成硫酸钡沉淀.
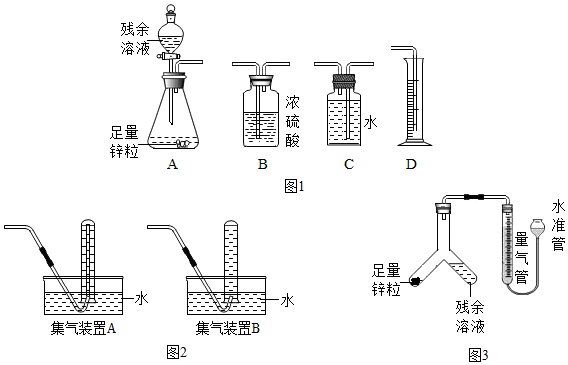
(3)①图1中最简易的装置及其连接顺序是A→C→D,A中产生的气体排入C中,C中排入D中的水的体积即为反应生成气体的体积.
故填:A→C→D.
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后残余清液就不能顺利滴入锥形瓶.其原因是反应产生大量气体,使瓶中压强增大.
故填:反应产生大量气体,使瓶中压强增大.
③某学生想用排水法收集氢气并检验其纯度,应选择图2中的集气装置B.
故选:B.
(4)①A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差,说明装置不漏气;
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平,说明装置漏气.
故选:A.
②实验中残余清液与锌粒混合后,锌和稀硫酸反应生成硫酸锌和氢气,和硫酸铜反应生成硫酸锌和铜,过程中的现象是锌粒逐渐溶解、生成红色固体、溶液逐渐由蓝色变成无色、产生大量气泡,放出热量.
故填:生成红色固体,溶液逐渐由蓝色变成无色.
③反应完毕后,气体体积逐渐减小的原因是气体在冷却过程中体积逐渐减小.
故填:气体在冷却过程中体积逐渐减小.
④a.装置漏气时,会导致收集的气体偏少,从而导致计算出的硫酸的溶质质量分数偏小;
b.读取数据时水准管的水面高于量气管的水面,导致气体体积偏小,从而导致计算出的硫酸的溶质质量分数偏小;
c.未待冷却就读取量气管读数,导致气体体积偏大,从而导致计算出的硫酸的溶质质量分数偏大.
故选:c.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 不能用木炭代替红磷 | |
| B. | 燃烧匙中盛放过量的红磷 | |
| C. | 通过实验可以得出空气中氮气与氧气的体积比约为5:1 | |
| D. | 氮气不与红磷反应且难溶于水,是设计该实验的依据之一 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 儿童缺锌会患智力低下;生成盐和水的反应都是中和反应 | |
| B. | 向某NaOH溶液中滴加几滴盐酸没有气泡则未变质;合金的熔点都高于它的成分金属 | |
| C. | 用洗洁精乳化试管壁上的油脂;使用新能源,能减少酸雨产生 | |
| D. | 用铁质容器配制农药波尔多液;吹灭蜡烛的原理是降低了着火点 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图是某胃药标签的部分内容.晓彤同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g,称得反应后烧杯内物质的总质量为64.3g.请计算:
如图是某胃药标签的部分内容.晓彤同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g,称得反应后烧杯内物质的总质量为64.3g.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 操作方法 |
| A | CO(CO2) | 氢氧化钠溶液 | 气体通过盛有足量氢氧化钠溶液的洗气瓶 |
| B | K2CO3(KCl) | 稀盐酸 | 加入足量稀盐酸、蒸发、结晶 |
| C | FeSO4 (CuSO4) | 锌粉 | 加入足量锌粉并过滤 |
| D | Zn(Fe) | 稀硫酸 | 加入足量的稀硫酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com