
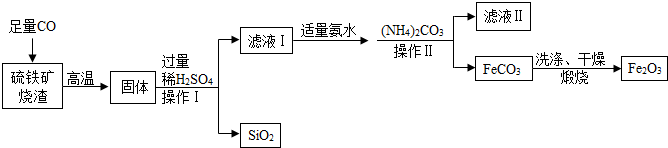
分析 (1)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳,和氧化亚铁反应生成铁和二氧化碳;
(2)过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒等.
(3)滤液Ⅰ中含有反应生成的硫酸亚铁和过量的硫酸等溶质;
(4)氨水能和稀硫酸反应生成硫酸铵,同时能够调节溶液的pH;
(4)碳酸铵和硫酸亚铁反应生成碳酸亚铁和硫酸铵.
解答 解:(1)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳,和氧化亚铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,或FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
(2)实验过程中,操作Ⅰ、操作Ⅱ都是过滤,用到的玻璃仪器有漏斗、烧杯、玻璃棒等.
故填:玻璃棒.
(3)滤液Ⅰ中的阳离子主要是Fe2+、H+等.
故填:Fe2+、H+.
(4)加适量氨水的目的是除去过量的硫酸,调节溶液的酸碱度.
故填:除去过量的硫酸,调节溶液的酸碱度.
(4)碳酸铵和硫酸亚铁反应生成碳酸亚铁和硫酸铵,反应的化学方程式为:(NH4)2CO3+FeSO4=FeCO3+(NH4)2SO4,属于复分解反应.
故填:(NH4)2CO3+FeSO4=FeCO3+(NH4)2SO4;复分解反应.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 等于35% | B. | 大于35% | C. | 小于35% | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
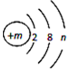 如图是某种粒子(原子或离子)的结构示意图
如图是某种粒子(原子或离子)的结构示意图查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.
自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
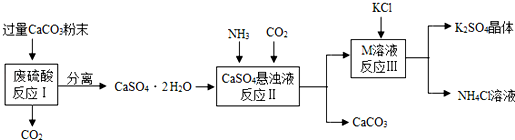
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
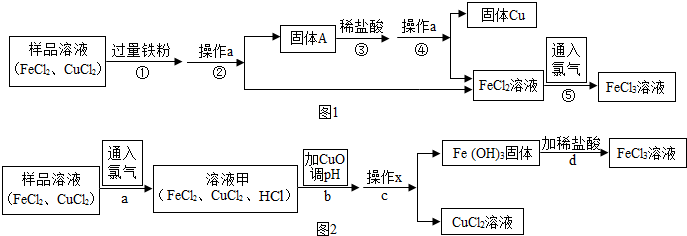
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com