
 同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
分析 煅烧石灰石时碳酸钙分解放出二氧化碳而使反应后固体质量减小,直到碳酸钙完全分解,剩余固体质量不再改变;利用质量守恒定律,由反应前后固体质量差计算出反应放出二氧化碳的质量,然后由反应的化学方程式,利用放出二氧化碳的质量求得石灰石样品中所含碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.根据表中数据画出图象
解答 解:(1)由实验记录数据可知,在反应进行至t5时,继续煅烧剩余固体质量不再减小,说明碳酸钙已完全分解,根据质量守恒定律,生成二氧化碳的质量=80g-58g=22g
故答案为:22;
(2)设80g石灰石中含CaCO3的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 44
x 22g
$\frac{100}{44}=\frac{x}{22g}$
x=50g
石灰石中CaCO3的质量分数为:$\frac{50g}{80g}$×100%=62.5%
答:该石灰石中CaCO3的质量分数为62.5%.
(3)根据表中数据画图如下: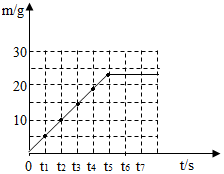 .
.
点评 利用图表中的数据,结合质量守恒定律分析得到生成二氧化碳的质量,是解决问题的基础,也体现分析问题的能力.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
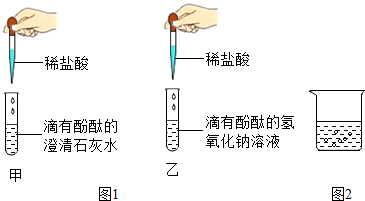
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 推广玉米生产的燃料可在一定程度上缓解当前的能源危机 | |
| B. | 微量元素对人体健康很重要,但过多摄入微量元素不利于健康 | |
| C. | 生活中一水多用,以节约水资源 | |
| D. | 麦秸和稻草焚烧后生成草木灰,草木灰是钾肥,所以农民可以露天焚烧麦秸和稻草以增加土壤的肥效 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
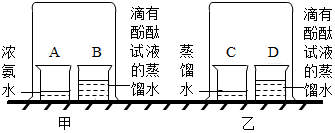
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
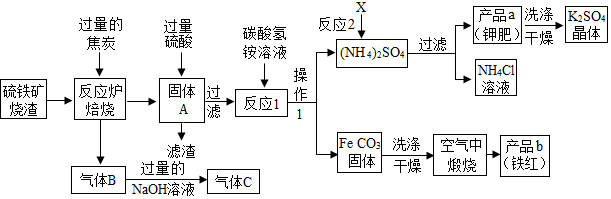
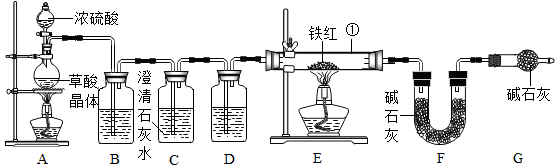
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com