
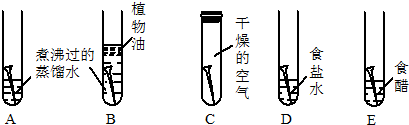
分析 (1)①要证明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果,就要看铁分别在隔绝空气、隔绝水的条件下,和暴露在有水和空气的条件下的不同,得出结论.
②试管D和E实验的目的是进一步探究铁在盐、酸存在的环境中铁的锈蚀情况;
③金属的组成和内部组织结构发生变化,其性质等就会发生变化;
(2)锌和稀硫酸反应生成硫酸锌和氢气;
(3)根据三种金属活动性由强到弱的顺序:锌铁铜,进行分析.
解答 解:(1))①要证明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果,就要看铁分别在隔绝空气、隔绝水的条件下,和暴露在有水和空气的条件下的不同,得出结论.所以必须全面观察试管ABC发生的现象,并经过科学严谨的推理,才能得出上述结论.
故答案为:ABC.
②试管D和E实验的目的是进一步探究铁在盐、酸存在的环境中铁的锈蚀情况.
故答案为:盐、酸存在.
③金属的组成和内部组织结构发生变化,其性质等就会发生变化.
故答案为:性质.
(2)锌和稀硫酸反应方程式为:Zn+H2SO4═ZnSO4+H2↑.
故答案为:Zn+H2SO4═ZnSO4+H2↑.
(3)三种金属活动性由强到弱的顺序:锌>铁>铜,可知铁只能置换出铜,根据铁与硝酸铜反应的方程式:Fe+Cu(NO3)2═Cu+Fe(NO3)2.可知56份质量的铁可以置换出64份质量的铜,所以反应后溶液质量比反应前减小.
故答案为:Cu;减小.
答案:
(1)①ABC;②盐、酸存在;③性质;
(2)Zn+H2SO4═ZnSO4+H2↑;
(3)Cu;减小.
点评 本题以实验探究的形式考查铁生锈的条件、实验中的条件控制、金属的活动性等,难度较大.


 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:选择题
| A. | 酸溶液pH小于7,但pH小于7的溶液不一定是酸溶液 | |
| B. | 在一定量的饱和石灰水中加入少量的CaO,其溶液质量不变 | |
| C. | 农药化肥能提高农作物的产量,故应大量使用农药化肥 | |
| D. | 10mL酒精和10mL水混合后体积小于20mL,是因为分子在不断地运动 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com