
分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,NaCl溶液、大理石属于混合物;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质,属于非金属单质的是氢气;由两种或两种以上的元素组成的纯净物叫化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.由原子直接构成的是铜,盐是电离出金属离子和酸根离子的化合物,碳酸钠属于盐.
解答 解:混合物是由两种或两种以上的物质组成,NaCl溶液、大理石属于混合物;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质,属于非金属单质的是氢气;由原子直接构成的是铜,盐是电离出金属离子和酸根离子的化合物,碳酸钠属于盐;故答案为:③⑥,⑤,①,Na2CO3
点评 本考点考查了物质的分类、物质的构成等,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.


科目:初中化学 来源: 题型:选择题
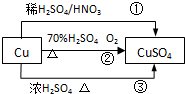 CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)| A. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| B. | 途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | 1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子的体积很小,肉眼看不到分子 | |
| B. | 在固态物质中,分子是静止的,只有在气态和液态物质中分子才是运动的 | |
| C. | 分子是不断运动的,构成分子的原子也是不断运动的 | |
| D. | 在化学变化中原子可能会重新组成新分子,也可能直接构成物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com