
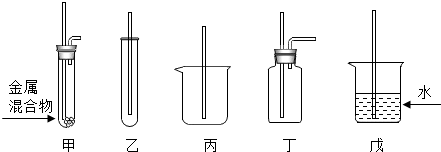
分析 (1)根据金属的活动性来分析;
(2)根据汞的沸点较低,可用加热的方法加以分离;
(3)剩余的混合物为铜与铁的混合物,根据金属的性质结合分离混合物的方法加以分析解答;
(4)根据金属的活动性来分析;
(5)根据分离汞蒸气来分析;从该装置需要加热以及分离汞蒸气来分析;
(6)根据汞蒸气有毒来分析.
解答 解:(1)在金属活动顺序中,排在前面的金属可以把排在后面的金属从其盐溶液中置换出来,加入过量的铁,将Cu2+和Hg2+直接转化为金属单质;故填:Fe+CuSO4=FeSO4+Cu(或Hg(NO3)2+Fe=Fe(NO3)2+Hg);
(2)在加热的条件下,金属混合物中的汞转化为蒸汽而被分离出去,故填:酒精灯;
(3)剩余的金属混合物时铁和铜,根据金属的活动性可知,铜不与稀硫酸反应,铁反应,故可向甲中的固体残渣加入足量稀盐酸,充分反应后过滤,铜就留到了滤纸上,故填:稀硫酸;漏斗;过滤;
(4)分离出汞后的金属残渣为铁和铜的混合物,铁属于活泼金属,铜属于不活泼金属,可加入稀硫酸加以分离,铁与稀硫酸反应,铜与稀硫酸不反应,然后用过滤的方法加以分离;故填:稀硫酸;漏斗;过滤;
(5)在加热时,为了让汞蒸气排出来,需要通入氢气,且防止在加热的条件下铜和铁被氧化;因为在加热的条件下氧气能与铁和铜反应,故不能通入氧气,当然在挥发出汞蒸气的同时,也不能加入酸;因为该装置排出汞蒸气,所以装置的气密性要良好,因为汞蒸气的密度比空气大,所以导管要伸入试管的底部;故填:C;为了将装置内的汞蒸气排出来;防止在加热的条件下铜和铁被氧化;装置的气密性要良好;导管要伸入试管的底部;
(6)汞蒸气有毒,不能扩散到空气中,所以选择装置丁.故填:丁,汞蒸气有毒,防止扩散到空气中.
点评 本题考查了分离金属离子、提纯金属单质的方法,难度较大.


科目:初中化学 来源: 题型:填空题
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
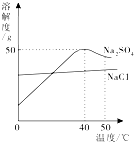
| A. | 温度升高,两种物质的溶解度都增大 | |
| B. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| C. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| D. | 40℃时,75g饱和Na2SO4溶液中含25g Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 石灰石样品质量 | 12g | 12g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 58.7g | 107.6g |
| 产生的CO2质量 | - | - |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 5.32 | B. | 3.59 | C. | 3.12 | D. | 2.37 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
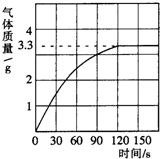 我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.
我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2H2O2═2H2O+O2↑ | B. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | ||
| C. | 2CO+Fe2O3═2Fe+2CO2 | D. | Fe2O3+6HCl═2FeCl2+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com