解:(1)亚硫酸钠氧化后得到物质为硫酸钠,而亚硫酸钠和硫酸钠都可以和氯化钡溶液反应生成白色的沉淀,但是亚硫酸钡可以溶于稀盐酸,而硫酸钡不溶于酸,即在酸性的环境中不能形成亚硫酸钡沉淀,所以为了防止亚硫酸根离子干扰实验现象,要加入稀盐酸来酸化;
(2)加入过量的氯化钡为了将溶液中的硫酸根离子全部转化为沉淀,以使结果更准确;
(3)如果加入的氯化钡是过量的则在滤液中依然存在着钡离子,那么若要验证滤液中是否含有钡离子,可以向滤液中加入硫酸钠,看是否能够产生沉淀,如果产生了沉淀,说明氯化钡是过量的,如果没有白色沉淀产生则说明氯化钡不是过量的;
(4)沉淀如果没有洗干净则在沉淀的表面会附着氯化钡,所以可以取最后一次洗涤液,滴加硝酸银溶液(硝酸酸化),若无沉淀则沉淀已洗净;
(5)根据题意可知发生的反应为硫酸钠和氯化钡的反应,同时生成硫酸钡的质量为W
2g,所以可以据此求出硫酸钠的质量,进而求出亚硫酸钠的质量,然后得出样品中亚硫酸钠的质量分数;
设硫酸钠的质量为x
BaCl
2+Na
2SO
4═2NaCl+BaSO
4↓
142 233
x W
2g
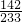
=
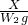
解得:x=
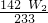
g
所以亚硫酸钠的质量分数可以表示为:
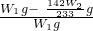
×100%=
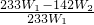
×100%.
故答案为:(1)防止生成BaSO
3沉淀.
(2)使SO
42-沉淀完全.
(3)向③的上层清液中加入氯化钡溶液,若无沉淀产生,则操作③已完成.
(4)取最后一次洗涤液,滴加硝酸银溶液(硝酸酸化)若无沉淀则沉淀已洗净.
(5)Na
2SO
3的质量分数表达式为:
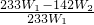
×100%.
分析:(1)亚硫酸钠钠可以和氯化钡反应生成白色沉淀,但是该白色沉淀可以溶于酸,可以据此解答;
(2)加入过量的氯化钡可以使样品中的硫酸根离子全部转化为沉淀而使就算结果更准确;
(3)如果氯化钡过量滤液中则会含有钡离子,所以可以据此来解答该题;
(4)沉淀如果没有洗干净则在沉淀的表面会附着氯化钡溶液,可以据此解答;
(5)根据化学方程式求出硫酸钠的质量进而可以表示出亚硫酸钠的质量分数.
点评:该考点的命题方向主要是以实验探究兼计算题的形式,给出有关的信息提示和相关数据,让学生通过实验探究,分析推断出该物质的组成成分;然后让学生根据有关的化学方程式和该物质的组成成分,进行综合计算.题型主要是实验探究题兼计算题的综合题型.中考的重点是考查学生通过实验的方法和有关化学方程式的计算,来研究物质的组成成分以及含量能力.

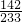 =
=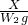
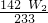 g
g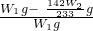 ×100%=
×100%=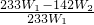 ×100%.
×100%.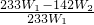 ×100%.
×100%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2012?杭州)雨、雪在形成和降落过程中吸收、溶解了空气中SO.及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
(2012?杭州)雨、雪在形成和降落过程中吸收、溶解了空气中SO.及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题: