(2012?邗江区二模)欲在室温和1.01×10
5Pa条件下测定镁的原子量.请利用如图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每种仪器只允许用一次).
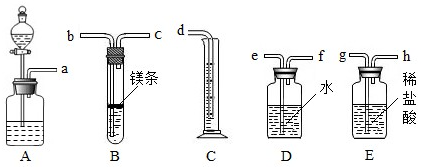
请回答下列问题:
(1)假设气流方向由左向右,则各仪器的接口连接的先后顺序为a→
g
g
→
h
h
→b→c→f→e→d(填写字母).
(2)装置A中的分液漏斗中盛放的液体是
水
水
,作用是
使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应
使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应
.
(3)连好仪器后,要进行的操作步骤有以下几步:
①待仪器B中的物质恢复至室温时,测量量筒C中水的体积(假设将测定的体积换算成标准状况下为VmL);
②擦掉镁条表面的氧化膜,将其置于天平上称量(假设其质量为mg),并将其投入试管B 中;
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞.
上述几步操作的先后顺序是
③②④①
③②④①
.
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响)
偏低
偏低
.
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响)
偏高
偏高
.
(6)甲、乙、丙三位同学用下图装置来测定一定质量的镁完全反应后生成氢气的体积:
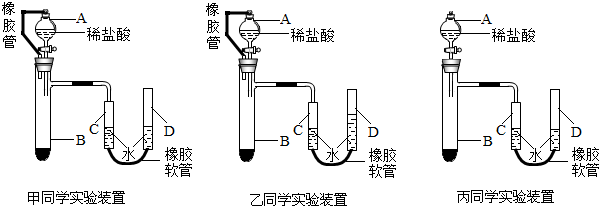
实验步骤如下:
1检查装置的气密性;
②向试管B中加入镁条;
③准确操作,记录C中液面刻度(C为带有刻度的量气管,D为可上下移动的水准管);
④由A向B中滴加稀盐酸至过量;
⑤B中不在有气体产生并恢复至室温后,准确操作,记录C中液面刻度,计算得到气体的体积为Vml
Ⅰ、甲同学检查该装置气密性的方法是连接好装置,从D管注水,C、D两管液面形成高度差,做好标记,一段时间后,两边高度差
不变
不变
(填“变大”、“变小”或“不变”),说明气密性良好.为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平、冷至室温外,还应
调节D管,使CD两边液面相平
调节D管,使CD两边液面相平
;
Ⅱ、甲同学认为镁带在实验前应打磨,目的是
除去表面的氧化镁
除去表面的氧化镁
;
Ⅲ、通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验:
重新实验
重新实验
;理由是
中途加酸会使气体溢出
中途加酸会使气体溢出
.
Ⅳ、以上是乙、丙两位同学所用实验装置,在步骤⑤读数时所处的稳定状态图,则将会对实验结果产生的影响是(假设其余步骤完善且操作准确无误):乙
偏小
偏小
,丙
偏大
偏大
(填“偏大”、“偏小”或“无影响”).

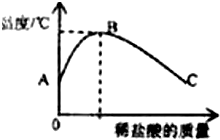 室温下,将稀盐酸滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示,下列叙述正确的是
室温下,将稀盐酸滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示,下列叙述正确的是

 物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.

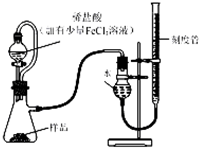 过氧化镁样品中常会混有少量MgO,实验室测定过氧化镁样品的纯度,装置如图,实验步骤如下:
过氧化镁样品中常会混有少量MgO,实验室测定过氧化镁样品的纯度,装置如图,实验步骤如下: