
分析 ①离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
②化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后.
解答 解:①由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.2个铵根离子可表示为2NH4+.
②过氧化氢中氢元素显+1价,氧元素的化合价为-1价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故过氧化氢中氧元素的化合价可表示为:H2$\stackrel{-1}{O}$2.
故答案为:①2NH4+;②H2$\stackrel{-1}{O}$2.
点评 本题难度不大,掌握常见化学用语(化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:推断题
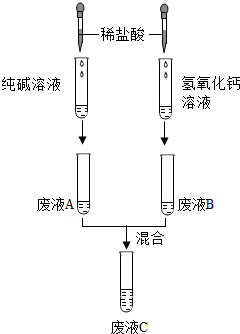 如下是小符同学在鉴别纯碱溶液和氢氧化钙溶液时所进行的系列实验:
如下是小符同学在鉴别纯碱溶液和氢氧化钙溶液时所进行的系列实验:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 可燃物 | 红磷 | 木炭 | 硫 | 蜡烛 | 铁丝 |
| 氧指数 | 0.5% | 4% | 4.5% | 5%~6% | 60% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
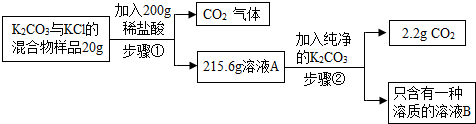
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 | |
| 取少量制得的溶液于试管中,加入过量的氯化钙溶液 | 产生白色沉淀 | 原来制得的溶液中含有Na2CO3 | |
| 将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的稀盐酸 | 无气泡产生 | 原来制得的溶液中不含NaHCO3 |
| 取另一份加入MgCl2溶液 | 不产生沉淀 | 原来制得的溶液中不含NaOH | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
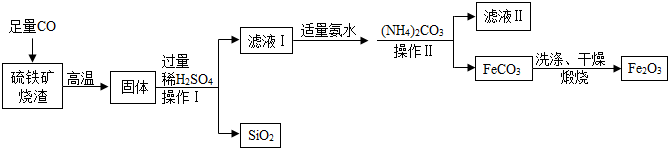
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
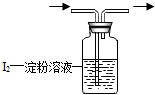 为判断某物质存在或某物质恰好完全反应,通常以特定物质的显色达到目,能显色的物质就称“指示剂”.如:用蓝色的石蕊试纸变红判断待测液显酸性;用淀粉溶液变蓝判断单质碘(I2)的存在
为判断某物质存在或某物质恰好完全反应,通常以特定物质的显色达到目,能显色的物质就称“指示剂”.如:用蓝色的石蕊试纸变红判断待测液显酸性;用淀粉溶液变蓝判断单质碘(I2)的存在查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将氢氧化钠固体直接放在托盘天平的托盘上称量 | |
| B. | 稀释浓硫酸时应将水注入浓硫酸中,并用玻璃棒不断搅拌 | |
| C. | 为了节约药品,实验室用剩的药品应放回原瓶 | |
| D. | 用量筒量取一定量的液体时,应该平视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com