
分析 由生铁的质量、杂质的质量分数、赤铁矿石中氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出所需赤铁矿石的质量.
解答 解:设需要含氧化铁质量分数为90%的赤铁矿石的质量为x.
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
90%x 2000t×(1-3%)
$\frac{160}{112}=\frac{90%x}{2000t×(1-3%)}$ x≈3079.4t
答:需要含氧化铁质量分数为90%的赤铁矿石3079.4t.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:初中化学 来源: 题型:选择题
| A. | K2SO4溶液(K2CO3):加入适量的稀硫酸 | |
| B. | Cu(Fe):加入过量的CuCl2溶液,过滤,洗涤,干燥 | |
| C. | NaCl (泥沙):加水溶解,再过滤,最后蒸发结晶 | |
| D. | CO2(HCl):将气体通过氢氧化钠溶液,再通过浓硫酸干燥 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验室往往因潮湿和腐蚀而损坏药品标签.现有一瓶标签受到腐蚀的无色溶液(如图所示),老师布置各小组开展探究.
实验室往往因潮湿和腐蚀而损坏药品标签.现有一瓶标签受到腐蚀的无色溶液(如图所示),老师布置各小组开展探究.| 实验操作 | 实验现象 |
| ①取少重该无色溶液于试管中,慢惺滴加BaC12溶液 ②静置后,倾去上层清液,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大重气泡,沉淀消失. |
| 实验操作 | 实验现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
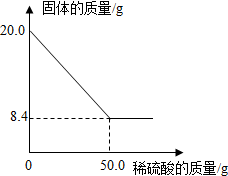 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com