
【题目】某化学兴趣小组探究在实验室中由Cu为原料制取CuSO4溶液的实验方案,并进行评价分析、实验探究和方案改进. 【实验方案】
方案一:Cu ![]() CuO
CuO ![]() CuSO4
CuSO4
方案二:Cu ![]() CuSO4[Cu+H2O2+H2SO4(稀)═CuSO4+2H2O]
CuSO4[Cu+H2O2+H2SO4(稀)═CuSO4+2H2O]
方案三:Cu ![]() CuSO4[Cu+2H2SO4(浓)
CuSO4[Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O]
CuSO4+SO2↑+2H2O]
方案四:Cu ![]() CuSO4[Cu+Fe2(SO4)3═CuSO4+2FeSO4]
CuSO4[Cu+Fe2(SO4)3═CuSO4+2FeSO4]
方案五:Cu ![]() CuSO4[3Cu+3H2SO4(稀)+2HNO3(稀)═3CuSO4+2NO↑+4H2O]
CuSO4[3Cu+3H2SO4(稀)+2HNO3(稀)═3CuSO4+2NO↑+4H2O]
【评价分析】
(1)方案二与方案一相比,优点是实验的操作步骤不需要走分步进行和 . 但工业上不采用方案二大量使用H2O2制硫酸铜的原因是 .
(2)方案三与方案一、二相比,缺点是和反应会产生SO2 . 生产生活中大量的SO2排放到空气中容易形成 .
(3)【实验探究】 老师设计了如下的实验方案四: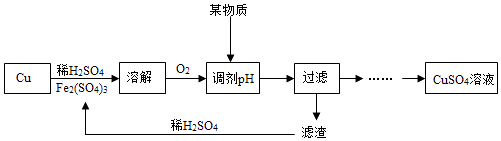
已知:①4FeSO4+O2+2H2SO4(稀)═2Fe2(SO4)3+2H2O
②溶液中pH=3.2时Fe(OH)3开始沉淀,实验流程中“滤渣”的化学式为 , 滤渣与稀H2SO4反应的化学方程式为 .
(4)【方案改进】 某同学针对方案五查阅资料:Cu与稀H2SO4和稀HNO3的混合酸反应时,生成的无色NO气体很容易在常温下与空气中的O2反应,生成红棕色,有刺激性气味的有毒气体NO2:NO2溶于H2O时生成HNO3和NO,工业上利用这一生产原理生产HNO3 . NO2溶于H2O的化学反应方程式为 , 若采用方案五制取CuSO4溶液,根据上述查阅资料所获得的反应原理,改进的实验方案中可循环使用的物质是(填化学式).
【答案】
(1)不需要加热;成本高
(2)生成相同质量硫酸铜时消耗硫酸多;酸雨
(3)Fe(OH)3;2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
(4)3NO2+H2O=2HNO3+NO;NO2.
【解析】解:(1)方案二与方案一相比,优点是实验的操作步骤不需要走分步进行和不需要加热;
但工业上不采用方案二大量使用H2O2制硫酸铜的原因是:需要消耗大量的过氧化氢,成本高.
故填:不需要加热;成本高.(2)方案三与方案一、二相比,缺点是生成相同质量硫酸铜时消耗硫酸多和反应会产生SO2;
生产生活中大量的SO2排放到空气中时,二氧化硫能和水反应生成亚硫酸、硫酸等物质,容易形成酸雨.故填:生成相同质量硫酸铜时消耗硫酸多;酸雨.(3)②溶液中pH=3.2时Fe(OH)3开始沉淀,实验流程中“滤渣”是氢氧化铁,氢氧化铁的化学式为Fe(OH)3;
氢氧化铁与稀H2SO4反应生成硫酸铁和水,反应的化学方程式为;2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.
故填:Fe(OH)3;2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.(4)NO2溶于H2O时生成HNO3和NO,反应的化学方程式为:3NO2+H2O=2HNO3+NO;
若采用方案五制取CuSO4溶液,根据上述查阅资料所获得的反应原理,改进的实验方案中可循环使用的物质是NO2.
故填:3NO2+H2O=2HNO3+NO;NO2.
【考点精析】通过灵活运用金属材料的选择依据和书写化学方程式、文字表达式、电离方程式,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号即可以解答此题.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:初中化学 来源: 题型:
【题目】某无色气体中可能含有CO、CO2、H2、N2中的一种或几种,现将该气体通过下图所示装置,观察到Ⅰ:A装置内未见浑浊出现;Ⅱ:D装置内无水硫酸铜变蓝;
Ⅲ:E装置无明显现象;最终收集到一定量干燥气体(假设每步反应完全,浓硫酸具有吸水性)。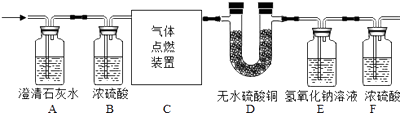
请回答下列问题:
① 由Ⅰ可知混合气体中肯定不含有;
② 由Ⅱ可知混合气体中肯定含有;
③ 最终收集到的气体是;
④ 为了确定该混合气体的最终组成,还需补充的实验或改进的操作是。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】说法正确的是
A.物质的量表示含有一定数目粒子集合的物理量
B.与盐酸反应放出气体的物质一定是碳酸盐
C.伴随发光发热现象的变化一定是化学变化
D.盐的组成中一定含有金属元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】欲除去氮气中的少量氧气、水蒸气、一氧化碳、二氧化碳等杂质,可使混合气体通过下列物质:(1)澄清的石灰水;(2)灼热的氧化铜;(3)灼热的铜;(4)浓硫酸。顺序正确的是( )
A.(1)(2)(3)(4)
B.(3)(2)(1)(4)
C.(4)(2)(1)(3)
D.(2)(4)(3)(1)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图A~F是实验室制备某些常见气体的装置示意图.
(1)装置图中仪器a的名称为。
(2)用氯酸钾和二氧化锰混合共热制取氧气,写出反应的化学方程式:。
(3)实验室利用B装置制取二氧化碳的化学方程式为 , 如果利用G装置收集二氧化碳,气体应从 端通入(填“b”或“c”),用C装置代替B装置作为发生装置,其主要优点是。
(4)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
比较项目 | 排水法 | 向上排空气法 |
收集方法可行性分析 | 因为CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率,所以可用排水法收集。 | 因为 , 所以可用向上排空气法收集。 |
收集过程分析 | 用排水法收集CO2 , 集满现象是: | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽 |
向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
由上述实验可得结论 | 与排空气法相比,排水法的优点是: | |
(5)查阅资料可知:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与无色硝酸溶液反应,其化学方程式为Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑+2H2O。
反应生成的NO2是红棕色、有刺激性气味的有毒气体。可用下图所示装置进行实验,请回答:
①检查装置的气密性:关闭弹簧夹,将干燥管放入带有水的烧杯中,若观察到 , 则表明该装置的气密性良好。
②打开弹簧夹,用注射器慢慢抽取干燥管内的气体,浓硝酸沿着干燥管慢慢上升,直到硝酸与铜片接触,停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象是:。
③上述实验完成后,须用足量NaOH溶液将气体吸收,其目的是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com