
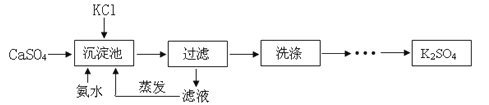
”¾ĢāÄæ”æA”«K¾łŹĒ³õÖŠ»Æѧ֊³£¼ūµÄĪļÖŹ£®ĖüĆĒÖ®¼äÓŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ¹ŲĻµ”£ĘäÖŠA”¢DĪŖ³£¼ūµÄ·Ē½šŹōµ„ÖŹ£¬G”¢IĪŖ³£¼ūµÄ½šŹōµ„ÖŹ£¬EŹĒĢśŠāµÄÖ÷ŅŖ³É·Ö£»³£ĪĀĻĀ£¬C”¢D”¢F¾łĪŖĪŽÉ«ĘųĢ壬ĒŅC”¢D¾ßÓŠæÉČ¼ŠŌ£¬BŹĒÉś»īÖŠ×ī³£¼ūµÄŅ»ÖÖŅŗĢ壬JĪŖĄ¶É«ČÜŅŗ”£

£Ø1£©·“Ó¦¢ŪŹōÓŚ ·“Ó¦£ØĢī»ł±¾·“Ó¦ĄąŠĶ£©”£
£Ø2£©Š“³öEŗĶHµÄ»ÆѧŹ½£ŗ E £»H ”£
£Ø3£©·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ ”£
·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ĪŖ ”£
”¾“š°ø”æ£Ø1£© ÖĆ»»·“Ó¦ £Ø2£©E Fe2O3 H CuO
£Ø3£© C + H20 == CO + H2 Fe + CuCl2(CuSO4) == Cu + FeCl2(FeSO4)
”¾½āĪö”æ
ŹŌĢā·ÖĪö”ĆÕāŹĒŅ»µĄĶʶĻĢā£¬øł¾Ż³õÖŠ»Æѧ֊³£¼ūĪļÖŹµÄŠŌÖŹŗĶ·“Ó¦£¬EĢśŠāµÄÖ÷ŅŖ³É·ÖŹĒŃõ»ÆĢś Fe2O3 £¬GÓ¦ŹĒ½šŹōFe.BÉś»īÖŠ×ī³£¼ūµÄŅ»ÖÖŅŗĢåŹĒĖ®£¬JĄ¶É«ČÜŅŗŹĒæÉČÜŠŌĶŃĪ£¬IÓ¦ŹĒCu”£æÉČ¼ŠŌĘųĢåÓŠŅ»Ńõ»ÆĢ¼£¬ĒāĘų£¬¼×ĶéµČ”£ÓÉ“ĖĶĘÖŖAŹĒC£¬BŹĒĖ®”£H CuO £Ø3£© C + H20 == CO + H2 Fe + CuCl2(CuSO4) == Cu + FeCl2(FeSO4)
æ¼µć”Ćæ¼²é³õÖŠ»Æѧ֊³£¼ūĪļÖŹµÄŠŌÖŹŗĶ·“Ó¦”£


 ¼ĘĖćøߏÖĻµĮŠ“š°ø
¼ĘĖćøߏÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŌŖĖŲRµÄŌ×ÓŠņŹżĪŖm£¬Äܹ»ŠĪ³ÉŗĖĶāÓŠxøöµē×ÓµÄRn+Ąė×Ó£¬ŌņĻĀĮŠ¹ŲĻµŹ½Ņ»¶ØÕżČ·µÄŹĒ£Ø £©
A£®m = n B£®m = n + x C£®m = n-x D£®m = x©n
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹ²»ÄÜÓėBaCl2ČÜŅŗ·¢Éś·“Ó¦µÄŹĒ£Ø £©
A£®CuSO4 B£®AgNO3 C£®CaCl2 D£®Na2CO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŅĒĘ÷²»ÄÜÓĆĄ“¼ÓČȵďĒ£Ø £©
A.ŹŌ¹Ü B.¼ÆĘųĘæ C.ÉÕ± D.ŪįŪö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅ½«øßĆĢĖį¼Ų¼ÓČČÖĘČ”ŃõĘųÖ÷ŅŖÓŠŅŌĻĀ²½Öč£ŗa£®¼ÓČČŹ¢ÓŠŅ©Ę·µÄŹŌ¹Ü£»b£®ĻņŹŌ¹ÜÖŠ¼ÓČėŅ©Ę·£»c£®¼ģ²é×°ÖƵÄĘųĆÜŠŌ£»d£®ŹÕ¼ÆĘųĢ壻e£®Ķ£Ö¹¼ÓČČ£»f£®½«µ¼¹Ü“ÓĖ®²ŪÖŠČ”³ö”£ÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ£Ø £©
A£®c b a d e f B£®c b a d f e C£®b a d c f e D£®d a c f b e
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹÆøą·ØÖĘČ”ĮņĖį¼Ų¾ßÓŠÄÜŗĵĶ£¬ŌĮĻĄ“Ō“¹ćµČÓŵć¶ų±»Ģ½Ė÷”£ŅŌĮņĖįøĘÓėĀČ»Æ¼ŲĪŖŌĮĻÖʱøĮņĖį¼ŲµÄĮ÷³ĢČēĻĀ£ŗ
ŅŃÖŖĮņĖį¼ŲŌŚ²»Ķ¬ĪĀ¶ČĻĀŌŚĖ®ČÜŅŗ”¢°±ČÜŅŗÖŠµÄČܽā¶Č£Øg£©
ĪĀ¶Č£Ø”ę£© | 0 | 10 | 26 | 30 |
Ė®ČÜŅŗ | 7.31 | 9.28 | 11.03 | 12.98 |
°±£Ø8%£©ČÜŅŗ | 1.41 | 1.58 | 2.25 | 3.36 |
°±£Ø35%£©ČÜŅŗ | 0.44 | 0.75 | 0.82 | ·Ē³£Ń¹ |
£Ø1£©°±Ė®ĻŌ £ØĢī”°ĖįŠŌ”±”¢”°¼īŠŌ”±»ņ”°ÖŠŠŌ”±£©£¬ĻņĖ®ÖŠĮ¬ŠųĶØ°±Ęų“ļĮ½øöŠ”Ź±æɵĆøßÅØ¶Č°±Ė®£¬°±Ęų²»¶ĻČܽāŹ¹ČÜŅŗpH £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£ÉĻ±ķÖŠ”°·Ē³£Ń¹”±ÖøŠčŌö“óĘųŃ¹²ÅÄÜŠĪ³É30”ęµÄ°±£Ø35%£©ČÜŅŗ£¬³£Ń¹ĻĀ²»ÄÜŠĪ³É30”ęµÄ°±£Ø35%£©ČÜŅŗµÄŌŅņŹĒ ”£
£Ø2£©³Įµķ³ŲÖŠ°±Ė®ÅØ¶Č³£³£æŲÖĘŌŚ25%ÖĮ40%£¬ĘäŌŅņŹĒ £¬³Įµķ³ŲĪĀ¶ČŹŹŅĖ±£³ÖŌŚ
£ØŃ”Ģī”°µĶĪĀ”±»ņ”°øßĪĀ”±£©”£
£Ø3£©ĀĖŅŗ¾Õō·¢ŗó²śÉśæÉŅŌŃ»·Ź¹ÓƵÄĘųĢ壬Ęä»ÆѧŹ½ĪŖ £»ĀĖŅŗÖŠµÄø±²śĘ·ĀČ»ÆøĘæÉ×Ŗ»Æ³ÉĢ¼ĖįøĘ¹ĢĢ壬ÓėHNO3·“Ó¦ÖʱøCa(NO3)2”¤6H2O¾§Ģ壬ĪŖČ·±£Öʱø¹ż³ĢÖŠ¼Č²»²¹³äĖ®£¬Ņ²ĪŽ¶ąÓąµÄĖ®£¬ĖłÓĆĻõĖįČÜŅŗÖŠČÜÖŹÓėČܼĮµÄÖŹĮæ±ČĪŖ ”£
£Ø4£©ŹµŃéŹŅ½ųŠŠ¹żĀĖ²Ł×÷ŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠÉÕ±”¢²£Į§°ō”¢ £¬ĘäÖŠ²£Į§°ōŌŚĻ”ŹĶÅØĮņĖįŹ±Ņ²ÓƵ½£¬Ļ”ŹĶÅØĮņĖįŹ±ÓƵ½²£Į§°ōµÄÖ÷ŅŖ×÷ÓĆĪŖ ”£
£Ø5£©¼ģŃé³ĮµķŹĒ·ńĻ“¾»µÄŹŌ¼ĮŹĒ £ØĢīŠņŗÅ£©
A£®·ÓĢŖŹŌŅŗ BĢ¼ĖįÄĘČÜŅŗ CĀČ»Æ±µČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼īŹ½Ģ¼ĖįĆ¾øßĪĀÄÜ·Ö½ā£¬æÉÓĆÓŚĆ¾ŃĪÖʱø£¬ÖĘŅ©¹¤ŅµµČ”£Ęä×é³ÉŅ»°ćŅŌxMgCO3”¤yMg(OH)2”¤zH2O±ķŹ¾”£
¢ń£®ŃŠ¾æĘä·Ö½ā²śĪļ
£Ø1£©Č”ŃłøßĪĀ×ĘÉÕ£¬¼ģ²āµ½ÓŠ¶žŃõ»ÆĢ¼ŗĶĖ®Éś³É£¬³ä·Ö·“Ó¦ŗó£¬µĆµ½°×É«¹ĢĢ壬ÓÉ“ĖĶʶĻÉś³ÉĪļÖŠæĻ¶Ø²»ŗ¬½šŹōĆ¾¼°µ„ÖŹĢ¼£¬ĄķÓÉŹĒ ”£
£Ø2£©¼ģŃéÉś³ÉĪļÖŠŹĒ·ńŗ¬ÓŠĢ¼ĖįĆ¾”¢ĒāŃõ»ÆĆ¾”£
²Ł×÷ĻÖĻó | ½įĀŪ | |
¢Ł | Č”ŹŹĮæÉś³ÉĪļÖĆÓŚŹŌ¹ÜÖŠ£¬ ”£ | Éś³ÉĪļÖŠ²»ŗ¬Ģ¼ĖįĆ¾”£ |
¢Ś | Č”ŹŹĮæÉś³ÉĪļÖĆÓŚŹŌ¹ÜÖŠ£¬¼ÓČėČČĖ®£¬µĪČė·ÓĢŖŹŌŅŗ£¬ ¹Ū²ģµ½ ĻÖĻó”£ | Éś³ÉĪļÖŠ²»ŗ¬ĒāŃõ»ÆĆ¾”£ |
£»£Ø3£©ÓĆ·ÓĢŖŹŌŅŗ¼ģŃéŹĒ·ń“ęŌŚĒāŃõ»ÆĆ¾²»ÄÜÓĆĄäĖ®“śĢęČČĖ®ŹĒŅņĪŖ ”£×ŪŗĻÉĻŹöŹµŃéĶʶĻ¼īŹ½Ģ¼ĖįĆ¾µÄ·Ö½ā²śĪļĪŖ¶žŃõ»ÆĢ¼”¢Ė®ŗĶ ”£
¢ņ£®²ā¶Ø¼īŹ½Ģ¼ĖįĆ¾ÖŠĢ¼ŌŖĖŲµÄÖŹĮæ·ÖŹż
°“ĻĀĶ¼Ņ»½ųŠŠŹµŃ锣
¢ŁĮæĘų¹Ü֊װӊ±„ŗĶĢ¼ĖįĒāÄĘČÜŅŗ£¬²»ÄÜÓĆĖ®“śĢęŹĒŅņĪŖ £¬ČōÓĆĻ”ŃĪĖį“śĢęĻ”ĮņĖį£¬Ōņ²ā³öĢ¼ŌŖĖŲµÄÖŹĮæ·ÖŹż½« £ØĢī”°Ę«“ó”±”¢”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±£©”£
¢ŚŹµŃéÖŠ¹²ĻūŗÄĻ”ĮņĖį20mL£¬øł¾ŻĖł²āŹż¾ŻĒóµĆÉś³ÉĘųĢåµÄÖŹĮæĪŖ1.32g£¬Ōņ½ųČėĮæĘų¹ÜµÄĘųĢåĢå»żĪŖ £¬Ģ¼ŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ ”££ØŹµŃéĢõ¼žĻĀCO2ĆܶČĪŖ1.97g/L£©

¢ó£®Č·¶Ø¼īŹ½Ģ¼ĖįĆ¾µÄ×é³É
Éč¼ĘČēÉĻĶ¼¶ž×°ÖĆ£¬²¢°“ĻĀŹö²½Öč²Ł×÷”£
²½Öč1£ŗ¼ģ²é×°ÖƵÄĘųĆÜŠŌ£¬½«36.4gѳʷÖĆÓŚŹŌ¹ÜÖŠ£¬³ĘĮæ×°ÖĆBµÄÖŹĮæĪŖ192g”£
²½Öč2£ŗ¼ÓČČ×°ÖĆAÖ±ÖĮѳʷĶźČ«·“Ó¦”£
²½Öč3£ŗÓĆÖ¹Ė®¼Š¼Š½ō×°ÖĆAŗĶ×°ÖĆB¼ä½ŗʤ¹Ü£¬Ķ£Ö¹¼ÓČČ£¬ĄäČ“ÖĮŹŅĪĀ”£
²½Öč4£ŗ³ĘĮæ×°ÖĆBµÄÖŹĮæĪŖ199.2g”£
(1)×°ÖĆBÖŠĪļÖŹĪŖ £¬×°ÖĆCµÄ×÷ÓĆĪŖ ”£ÅŠ¶ĻѳʷĶźČ«·“Ó¦µÄ·½·Ø£ŗµ±¹Ū²ģµ½×°ÖĆBÖŠ £¬ŌņѳʷŅŃĶźČ«·“Ó¦”£
£Ø2£©øł¾ŻÉĻŹöŹµŃ鏿¾ŻĒó³ö¼īŹ½Ģ¼ĖįĆ¾µÄ»ÆѧŹ½£¬Š“³ö¼ĘĖć¹ż³Ģ”£ £Ø3·Ö£©
¢ö£®ÓŠČĖĖµ”°¼ÓČČ¼īŹ½Ģ¼ĖįĆ¾×īŗó½×¶Ī¹ĢĢåÖŹĮæ¼õÉŁŹĒŅņĪŖÉś³É¶žŃõ»ÆĢ¼”±ŹĒÕęµÄĀš£æ
ĮķČ”Ņ»¶ØĮæ¼īŹ½Ģ¼ĖįĆ¾ŃłĘ·ŌŚæÕĘųÖŠ¼ÓČČ£¬²ā³öѳʷµÄ¹ĢĢ岊ĮōĀŹ£Ø![]() ”Į100%£©ĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā”£
”Į100%£©ĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā”£

¢Ł0ÖĮt1”ę¹ż³ĢÖŠ¹ĢĢåÖŹĮæ±£³Ö²»±äµÄŌŅņŹĒ ”£
¢Ś·ÖĪöĶ¼ĻńŹż¾ŻÅŠ¶ØøĆĖµ·ØŹĒ £ØĢī”°ÕęµÄ”±»ņ”°¼ŁµÄ”±£©£¬ÅŠ¶ØĄķÓÉŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¶ŌŌ×Ó¹¹³ÉµÄĄķ½ā“ķĪóµÄŹĒ
A£®Ō×ÓŗĖŹĒ²»æÉ·ÖøīµÄŹµŠÄĒņĢå B£®Ō×ÓŗĖŌŚŌ×ÓÖŠĖłÕ¼æÕ¼äŗÜŠ”
C£®Ō×ÓÕūĢå²»ĻŌµēŠŌ D£®Ō×ÓÖŹĮæÖ÷ŅŖ¼ÆÖŠŌŚŌ×ÓŗĖÉĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖ²ā¶ØijĶŠæ»ģŗĻĪļÖŠŠæµÄÖŹĮæ·ÖŹż£¬Ä³Ķ¬Ń§ĄūÓĆøĆŗĻ½šÓėĻ”ĮņĖį·“Ó¦£¬½ųŠŠĮĖČż“ĪŹµŃ飬ĖłµĆĻą¹ŲµÄŹµŃ鏿¾Ż¼ĒĀ¼ČēĻĀ£ŗ

¢ŁĆæŅ»“Ī·“Ó¦ÖŠÉś³ÉĒāĘųµÄĪļÖŹµÄĮæŹĒ £Ø1£© ”£
¢ŚŹŌ¼ĘĖćøĆĶŠæŗĻ½šÖŠŠæµÄÖŹĮæ·ÖŹż£ØŠ“³ö¼ĘĖć¹ż³Ģ£©”£ £Ø2£©
¢Ū“ÓÉĻ±ķŹż¾Ż·ÖĪö£¬µ±ĖłČ”ŗĻ½šÓėĖłÓĆĻ”ĮņĖįµÄÖŹĮæ±ČĪŖ £Ø3£© Ź±£¬±ķĆ÷ŗĻ½šÖŠµÄŠæÓėĻ”ĮņĖįÖŠµÄĮņĖįĒ”ŗĆĶźČ«·“Ó¦”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com