
 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
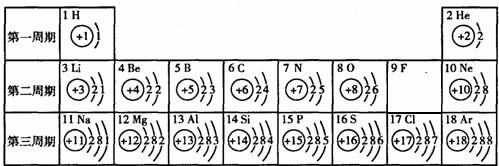
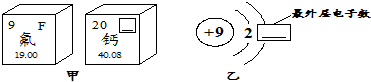
查看答案和解析>>
科目:初中化学 来源: 题型:



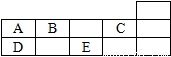
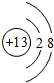 表示的是
表示的是查看答案和解析>>
科目:初中化学 来源: 题型:


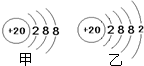
查看答案和解析>>
科目:初中化学 来源: 题型:
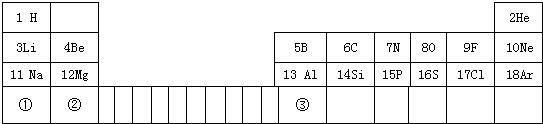
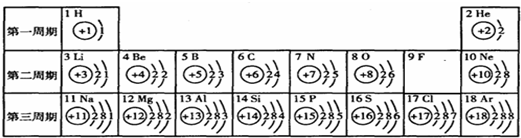
 (2004?扬州)俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
(2004?扬州)俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:| H 1 |
He 2 | ||||||||||||||||
| Li 3 |
Be 4 |
B 5 |
C 6 |
N 7 |
O 8 |
F 9 |
Ne 10 | ||||||||||
| Na 11 |
Mg 12 |
Al 13 |
Si 14 |
P 15 |
S 16 |
Cl 17 |
Ar 18 | ||||||||||
| ① | ② | ③ | |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com