
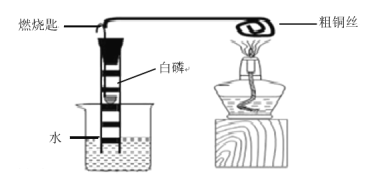
”¾ĢāÄæ”æ»ÆѧŹµŃ銔×éĶ¬Ń§ŌŚŹµŃéŹŅÓĆ¹żŃõ»ÆĒāČÜŅŗÖĘŃõĘų”£
£Ø1£©ÓĆ¹żŃõ»ÆĒāŗĶ¶žŃõ»ÆĆĢ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________________________”£
£Ø2£©Ķ¬Ń§ĆĒ·¢ĻÖ·“Ó¦Ź±ÓŠ°×Īķ²śÉś£¬ÓĆČēĻĀĮ½øö×°ÖĆĄ“ÕŅŌŅņ£¬ĘäÄæµÄŹĒ£ŗ___________”£
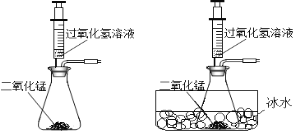
Ķ¬Ź±ÓÖÕ¹æŖĮĖĻĀĮŠĖ¼æ¼ÓėĢ½¾æ£ŗ
£Ø3£©“߻ƼĮMnO2µÄÓĆĮæ¶Ō·“Ó¦ĖŁĀŹŹĒ·ńÓŠÓ°ĻģÄŲ£æ
ĖūĆĒ×öĮĖÕāŃłŅ»×鏵Ńé£ŗĆæ“Ī¾łÓĆ30mL10%µÄH2O2ČÜŅŗ£¬²ÉÓĆ²»Ķ¬ÖŹĮæMnO2·ŪÄ©×ö“߻ƼĮ£¬²ā¶Øø÷“ĪŹÕ¼Æµ½500mLŃõĘųĖłÓƵď±¼ä£¬½į¹ūČēĻĀ£ŗ£ØĘäĖüŹµŃéĢõ¼ž¾łĻąĶ¬£©
ŹµŃé“ĪŠņ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
MnO2·ŪÄ©ÓĆĮæ£ØæĖ£© | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
ĖłÓĆŹ±¼ä£ØĆė£© | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 | 2 |
Ēėøł¾Ż±ķÖŠŹż¾Ż»Ų“š£¬MnO2·ŪÄ©µÄÓĆĮæ¶Ō·“Ó¦ĖŁĀŹµÄÓ°ĻģŹĒ___________”£
£Ø4£©H2O2ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹż¶Ō·“Ó¦ĖŁĀŹŹĒ·ńÓŠÓ°ĻģÄŲ£æŠ”×éĶ¬Ń§ÓÖ×öĮĖŅ»×鏵Ńé£ŗ
Ćæ“Ī¾łČ”5mL30%µÄH2O2ČÜŅŗ£¬Č»ŗóĻ”ŹĶ³É²»Ķ¬ČÜÖŹÖŹĮæ·ÖŹżµÄČÜŅŗ½ųŠŠŹµŃ锣¼ĒĀ¼Źż¾ŻČēĻĀ£ŗ£ØŹµŃé¾łŌŚ20”ęŹŅĪĀĻĀ½ųŠŠ£¬ĘäĖüŹµŃéĢõ¼ž¾łĻąĶ¬£©
ŹµŃé“ĪŠņ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
H2O2ČÜŅŗČÜÖŹÖŹĮæ·ÖŹż | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2·ŪÄ©ÓĆĮæ£ØæĖ£© | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
ŹÕ¼Æµ½540mLĘųĢåŹ±ĖłÓĆŹ±¼ä£ØĆė£© | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
·ÖĪö±ķÖŠŹż¾ŻæÉµĆ³öµÄ½įĀŪŹĒ___________”£
£Ø3£©ŹµŃé·“Ė¼£ŗMnO2æÅĮ£µÄ“󊔶Ō·“Ó¦ĖŁĀŹŹĒ·ńÓŠÓ°Ļģ£æĒėÉč¼ĘŹµŃéÖ¤Ć÷£ØÓļŃŌŠšŹö£¬²»ÓĆ»×°ÖĆĶ¼£©___________”£
”¾“š°ø”æ![]() °×ĪķµÄ²śÉśŹĒ·ńÓėĪĀ¶ČÓŠ¹Ų£ØĪĀ¶ČµĶŹĒ·ń»¹ÓŠ°×Īķ£© ŌŚŅ»¶Ø·¶Ī§ÄŚ£¬MnO2µÄÓĆĮæŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£»µ«ŹĒµ±MnO2“ļµ½0.5gŗóĖłÓĆŹ±¼ä¾ĶĻąĶ¬ĮĖ”£ĖłŅŌŌŚŅ»¶Ø·¶Ī§ÄŚŌö¼ÓMnO2¼Óæģ·“Ó¦ĖŁ¶Č”£ ĘäĖüĢõ¼žĻąĶ¬Ź±£¬H2O2ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżŌ½“󣬷“Ó¦Ō½æģ”£ ½«µČĮæ·ŪĩדŗĶæéדµÄMnO2ÖĆÓŚĮ½øöĻąĶ¬µÄŅĒĘ÷ÖŠ£¬Ķ¬Ź±¼ÓČėĶ¬Ģå»żĶ¬ÅØ¶ČµÄ¹żŃõ»ÆĒāČÜŅŗ£¬²ā¶ØŹÕ¼ÆĻąĶ¬Ģå»żµÄĘųĢåĖłÓƵď±¼ä”££Ø»ņĻąĶ¬µÄŹ±¼ä¼ĒĀ¼ŹÕ¼Æµ½ĘųĢåµÄĢå»ż£©”£
°×ĪķµÄ²śÉśŹĒ·ńÓėĪĀ¶ČÓŠ¹Ų£ØĪĀ¶ČµĶŹĒ·ń»¹ÓŠ°×Īķ£© ŌŚŅ»¶Ø·¶Ī§ÄŚ£¬MnO2µÄÓĆĮæŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£»µ«ŹĒµ±MnO2“ļµ½0.5gŗóĖłÓĆŹ±¼ä¾ĶĻąĶ¬ĮĖ”£ĖłŅŌŌŚŅ»¶Ø·¶Ī§ÄŚŌö¼ÓMnO2¼Óæģ·“Ó¦ĖŁ¶Č”£ ĘäĖüĢõ¼žĻąĶ¬Ź±£¬H2O2ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżŌ½“󣬷“Ó¦Ō½æģ”£ ½«µČĮæ·ŪĩדŗĶæéדµÄMnO2ÖĆÓŚĮ½øöĻąĶ¬µÄŅĒĘ÷ÖŠ£¬Ķ¬Ź±¼ÓČėĶ¬Ģå»żĶ¬ÅØ¶ČµÄ¹żŃõ»ÆĒāČÜŅŗ£¬²ā¶ØŹÕ¼ÆĻąĶ¬Ģå»żµÄĘųĢåĖłÓƵď±¼ä”££Ø»ņĻąĶ¬µÄŹ±¼ä¼ĒĀ¼ŹÕ¼Æµ½ĘųĢåµÄĢå»ż£©”£
”¾½āĪö”æ
£Ø1£©¹żŃõ»ÆĒāŌŚ¶žŃõ»ÆĆĢµÄ“ß»Æ×÷ÓĆĻĀ·Ö½āĪŖĖ®ŗĶŃõĘų£»¹ŹĢī£ŗ![]()
£Ø2£©¹żŃõ»ÆĒā·Ö½ā²śÉśŃõĘųµÄ¹ż³ĢÖŠæÉÄÜ»į·Å³öČČĮ棬Ź¹µĆĖ®Ęū»Æ¶ųŠĪ³É°×Īķ£¬ĖłŅŌÓĆĶ¼Ź¾Į½øö×°ÖĆĄ“ÕŅŌŅņ£¬ĘäÄæµÄŹĒ£ŗ°×ĪķµÄ²śÉśŹĒ·ńÓėĪĀ¶ČÓŠ¹Ų»ņĪĀ¶ČµĶŹĒ·ń»¹ÓŠ°×Īķ£»¹ŹĢī£ŗ°×ĪķµÄ²śÉśŹĒ·ńÓėĪĀ¶ČÓŠ¹Ų£Ø»ņĪĀ¶ČµĶŹĒ·ń»¹ÓŠ°×Īķ£©£»
£Ø3£©ÓɱķøńÖŠµÄŹż¾ŻæÉÖŖ£ŗŌŚŅ»¶Ø·¶Ī§ÄŚ£¬MnO2µÄÓĆĮæŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£»µ«ŹĒµ±MnO2“ļµ½0.5gŗóĖłÓĆŹ±¼ä¾ĶĻąĶ¬ĮĖ”£ĖłŅŌŌŚŅ»¶Ø·¶Ī§ÄŚŌö¼ÓMnO2¼Óæģ·“Ó¦ĖŁ¶Č£»¹ŹĢī£ŗŌŚŅ»¶Ø·¶Ī§ÄŚ£¬MnO2µÄÓĆĮæŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£»µ«ŹĒµ±MnO2“ļµ½0.5gŗóĖłÓĆŹ±¼ä¾ĶĻąĶ¬ĮĖ”£ĖłŅŌŌŚŅ»¶Ø·¶Ī§ÄŚŌö¼ÓMnO2¼Óæģ·“Ó¦ĖŁ¶Č£»
£Ø4£©ÓɱķøńÖŠµÄŹż¾ŻæÉÖŖ£ŗĘäĖüĢõ¼žĻąĶ¬Ź±£¬H2O2ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżŌ½“󣬷“Ó¦Ō½æģ£»¹ŹĢī£ŗĘäĖüĢõ¼žĻąĶ¬Ź±£¬H2O2ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżŌ½“󣬷“Ó¦Ō½æģ£»
£Ø5£©Ģ½¾æMnO2æÅĮ£µÄ“󊔶Ō·“Ó¦ĖŁĀŹŹĒ·ńÓŠÓ°ĻģŹ±£¬¶žŃõ»ÆĆĢµÄÖŹĮæÓĆĻąµČ£¬¹żŃõ»ÆĒāČÜŅŗµÄĢå»żÓėÅضČŅŖĶźČ«ĻąĶ¬£¬Ķعż²ā¶ØŹÕ¼ÆĻąĶ¬Ģå»żµÄŃõĘųĖłŠčŹ±¼ä£Ø»ņĻąĶ¬µÄŹ±¼ä¼ĒĀ¼ŹÕ¼Æµ½ĘųĢåµÄĢå»ż£©Ą“±Č½Ļ£»¹ŹĢī£ŗ½«µČĮæ·ŪĩדŗĶæéדµÄMnO2ÖĆÓŚĮ½øöĻąĶ¬µÄŅĒĘ÷ÖŠ£¬Ķ¬Ź±¼ÓČėĶ¬Ģå»żĶ¬ÅØ¶ČµÄ¹żŃõ»ÆĒāČÜŅŗ£¬²ā¶ØŹÕ¼ÆĻąĶ¬Ģå»żµÄĘųĢåĖłÓƵď±¼ä»ņĻąĶ¬µÄŹ±¼ä¼ĒĀ¼ŹÕ¼Æµ½ĘųĢåµÄĢå»ż£©”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ł±¾ŹµŃé²Ł×÷ÕżČ·µÄŹĒ£Ø””””£©
A.  ĪÅĘųĢåĘųĪ¶ B.
ĪÅĘųĢåĘųĪ¶ B.  Ļ”ŹĶÅØĮņĖį
Ļ”ŹĶÅØĮņĖį
C.  Õō·¢Ź³ŃĪĖ® D.
Õō·¢Ź³ŃĪĖ® D.  ²āČÜŅŗµÄpH
²āČÜŅŗµÄpH
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
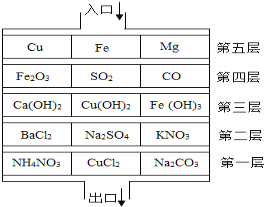
”¾ĢāÄæ”æČēĶ¼ČēŹ¾£¬Čō½«Ļ”H2SO4±Č×÷³õȿѧɜŌŚ”°Ó¦¼±ŃŻĮ·”±ÖŠ£¬ŅŖ“ÓĀ„¶„ČėæŚ“¦ÓÉÉĻÖĮĻĀŹčÉ¢µ½³öæŚ“¦£¬ø÷²ć¶¼ÓŠČżµĄĆÅ£Øæհד¦ĪŖĶصĄ£©£¬Ļ”ĮņĖįŅŖŌŚĆæ²ćÖŠÖĮÉŁ“ņæŖŅ»µĄĆţؼ“ÄÜÓėĻ”ĮņĖį·“Ó¦µÄĪļÖŹ£©²ÅÄܵ½“ļ³öæŚ“¦£¬Ēėøł¾ŻĶ¼Ź¾»Ų“šŅŌĻĀĪŹĢā£®
£Ø1£©Čō°“”°¾ąĄė×ī¶Ģ”±µÄŌŌņŹčÉ¢£¬ŌņĘäŹčÉ¢Ā·ĻßÓÉÉĻÖĮĻĀŅĄ“ĪĪŖ£ØĢī»ÆѧŹ½£©½ųæŚ”ś”” ”””ś³öæŚ”£Čō°“”°ĖŁ¶Č×īæģ”±£Ø»Æѧ·“Ó¦ĖŁ¶Č×īæģ£©µÄŌŌņŹčÉ¢£¬ŌņÓ¦½«ÉĻŹöŹčÉ¢Ā·ĻßÖŠµŚĪå²ćøÄĪŖ£ØĢī»ÆѧŹ½£©”” ””£¬ĖłÓŠĀ„²ćÖŠÄÜÓėĻ”ĮņĖį·“Ó¦µÄĪļÖŹ¹²ÓŠ”” ÖÖ”£
£Ø2£©Š“³öŹčÉ¢Ā·ĻßÉĻ¾¹żµŚČż²ćŹ±µÄĪļÖŹÓė¶žŃõ»ÆĢ¼·¢Éś·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½£ŗ”” ””£®Čō½«Ļ”ĮņĖįøÄĪŖĻ”ŃĪĖįŌņĪŽ·ØĶعżµŚ”” ²ć”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖŃŠ¾æĪļÖŹµÄČܽāĻÖĻ󣬽ųŠŠČēĻĀĢ½¾æ»ī¶Æ”£
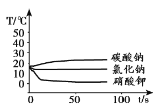
Ģ½¾æI£ŗ½«×ćĮæµÄĢ¼ĖįÄĘ”¢ĀČ»ÆÄĘŗĶĻõĖį¼ŲČżÖÖĪļÖŹ·Ö±šČܽāŌŚŅ»¶ØĮæµÄĖ®ÖŠ£¬Čܽā¹ż³ĢµÄĪĀ¶Č±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
Ģ½¾æII£ŗ
ŹµŃé |
¢Ł |
¢Ś |
¢Ū |
ĻÖĻó | ¹ĢĢåČܽā£¬ ŠĪ³É×ĻŗģÉ«ČÜŅŗ | ¹ĢĢåČܽā£¬ŠĪ³É×ĻŗģÉ«ČÜŅŗ | ¹ĢĢå¼øŗõ²»Čܽā |
Ģ½¾æIII£ŗ Ģ½¾æ¹ż³ĢČēĻĀĶ¼ĖłŹ¾£ŗ
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ģ½¾æIÖŠ£¬Čܽā¹ż³Ģ·Å³öČČĮæµÄĪļÖŹŹĒ__________”£
£Ø2£©¶ŌĢ½¾æIIÖŠŹµŃéĻÖĻó½ųŠŠ·ÖĪö£¬ŠčŅŖ×öµÄ¶Ō±ČŹĒ________”£·ÖĪöµĆ³öµÄ½įĀŪÖ®Ņ»ŹĒ__________”£
£Ø3£©Ģ½¾æIIIÖŠ£¬ĖłµĆČÜŅŗŅ»¶ØŹōÓŚ±„ŗĶČÜŅŗµÄŹĒ__________”£ĶعżøĆĢ½¾æµĆ³öµÄ½įĀŪŹĒ__________£Ø“šŅ»µć¼“æÉ£©”£
£Ø4£©ŌŚÉĻŹöĢ½¾æµÄ»ł“”ÉĻ£¬Ķ¬Ń§ĆĒĻėĶعżĢ½¾æ£¬±Č½ĻŹ³ŃĪŗĶĀČ»Æļ§ŌŚĖ®ÖŠµÄČܽā¶Č“󊔣¬Ģ½¾æ·½°øÓ¦øĆŹĒ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
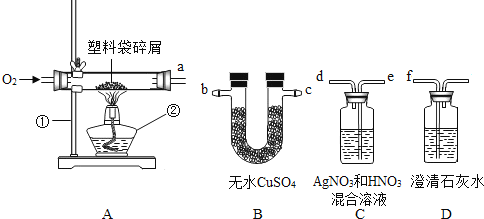
”¾ĢāÄæ”æÓĆČēĻĀĶ¼×°ÖĆ²ā¶ØæÕĘųÖŠŃõĘųŗ¬Įæ£Ø¼Š³Ö×°ÖĆŅŃĀŌČ„£©£¬×ó²ąÖ±²£Į§¹ÜÖŠŅŗĆęŅŌÉĻĘ½·ÖĪŖ5·Ż”£
£Ø1£©¼ÓČČĶĖææÉŅŌŅżČ¼°×Į×£¬ĄūÓƵďĒĶÓŠĮ¼ŗƵÄ_______ŠŌ”£
£Ø2£©ÄÜÖ¤Ć÷æÕĘųÖŠŃõĘųŗ¬ĮæµÄĻÖĻóŹĒ________________________”£
£Ø3£©ÓĆ°×Į×Äܲā¶ØæÕĘųÖŠŃõĘųŗ¬ĮæµÄŌŅņŹĒ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ£»ÆѧŠĖȤŠ”×é²Ī¹ŪÖĘ¼ī³§ŗ󣬻ńµĆŅŌĻĀŠÅĻ¢²¢¶ŌĻą¹ŲĪŹĢā½ųŠŠŃŠ¾æ£®
²śĘ·ŌĄķ£ŗøĆ³§²ÉÓĆ”°ŗīŹĻÖĘ¼ī·Ø”±Éś²ś»Æ¹¤²śĘ·©©“æ¼ī£ØNa2CO3£©ŗĶ»Æ·ŹNH4Cl£®
Éś²śŌĄķŹĒ£ŗ½«NH3ŗĶCO2ĶØČė±„ŗĶŹ³ŃĪĖ®ÖŠµĆµ½NaHCO3¾§ĢåŗĶNH4ClČÜŅŗ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ_____£»ŗó·ÖĄė³öNaHCO3£¬¼ÓČČÖʵƓæ¼ī£®
Éś²śĮ÷³Ģ£ŗ
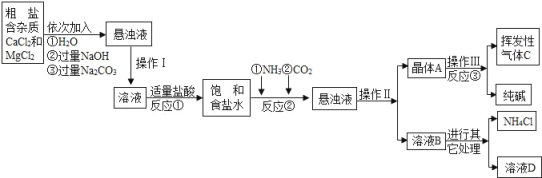
Ļą¹Ų׏ĮĻ£ŗ
£Ø1£©NH4Cl ![]() NH3”ü+HCl”ü
NH3ӟ+HClӟ
£Ø2£©ŅŃÖŖ20”ꏱӊ¹ŲĪļÖŹµÄČܽā¶ČČēĻĀ£ØĘųĢåÖø1Ģå»żĖ®ÖŠÄÜČܽāµÄĘųĢåĢå»ż£©
ĪļÖŹ | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
Čܽā¶Č | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
ĪŹĢāĢÖĀŪ£ŗ
£Ø1£©²Ł×÷¢ń”¢¢ņÖŠ£¬ĻąĶ¬²Ł×÷µÄĆū³ĘĪŖ_____£®·“Ó¦¢ŁÖŠ·¢ÉśĮĖĮ½øö·“Ó¦£¬Š“³öĘäÖŠŅ»øö»Æѧ·½³ĢŹ½£ŗ_____£¬·“Ó¦¢Ł¼ÓŹŹĮæµÄŃĪĖį£¬ŹŹĮæŹĒÖø_____£®
£Ø2£©¼ģŃé»Ó·¢ŠŌĘųĢåCµÄ·½·Ø_____£®
£Ø3£©ÉĻŹöÉś²śĮ÷³ĢÖŠæÉŃ»·Ź¹ÓƵďĒ_____£ØĢīŠņŗÅ£©£®
A»Ó·¢ŠŌĘųĢåC£» BČÜŅŗD£» CĒāŃõ»ÆĆ¾£»D»Æ·ŹNH4Cl
×é³ÉČ·¶Ø£ŗ
£Ø1£©³ĘČ”Ņ»¶ØÖŹĮæµÄ“æ¼īѳʷ£¬¾¶ą“Ī³ä·Ö¼ÓČČŗó£¬ŌŁ³ĘÖŲ£¬ÖŹĮæĪŽ±ä»Æ£»
£Ø2£©ĮķȔɣĮæ“æ¼īѳʷ¼ÓČėŹŹĮæĖ®£¬ŃłĘ·ĶźČ«Čܽā£¬ĻņøĆČÜŅŗÖŠ¼ÓČė¹żĮæĻ”HNO3£¬ŌŁµĪ¼ÓAgNO3ČÜŅŗ£¬ÓŠ°×É«³Įµķ£®ÓÉÉĻŹöŹµŃéæÉČ·¶Ø“æ¼īѳʷŗ¬ÓŠŌÓÖŹ_____£ØŠ“»ÆѧŹ½£©£®
ŗ¬Įæ²ā¶Ø£ŗ
ŹµŃéŅ» | ŹµŃ鶞 | ŹµŃéČż | ŹµŃéĖÄ | |
¹ĢĢå»ģŗĻĪļČÜŅŗÖŹĮæ | 100g | 100g | 100g | 100g |
¼ÓČėCaCl2ČÜŅŗÖŹĮæ | 10g | 20g | 30g | 40g |
Éś³ÉµÄ³ĮµķµÄÖŹĮæ | 4g | m | 10g | 10g |
³ĘČ”øĆ“æ¼īѳʷ44g¹ĢĢå»ģŗĻĪļ£¬¼ÓĖ®Åä³É400gČÜŅŗ£¬Ę½¾ł·ÖĪŖĖÄ·Ż£¬Č»ŗó·Ö±š¼ÓČėŅ»¶ØÖŹĮæ·ÖŹżµÄCaCl2ČÜŅŗ£¬ŹµŃ鏿¾Ż¼ū±ķ£ŗ
Ēė·ÖĪö±ķÖŠŹż¾Ż»Ų“š²¢¼ĘĖć£ŗ
£Ø1£©m£½_____g£»
£Ø2£©ŌŚŹµŃéČżÖŠ£¬ĶźČ«·“Ó¦ŗóĖłµĆČÜŅŗÖŠČÜÖŹĀČ»ÆÄʵÄÖŹĮæ·ÖŹżŹĒ¶ąÉŁ£æ_____£ØŅŖĒ󊓼ĘĖć¹ż³Ģ£¬½į¹ū±£Įō0.1%£©
×ܽį·“Ė¼£ŗ
ĒėĶعż¼ĘĖć²¢½įŗĻĻĀ±ķÅŠ¶Ļ“Ė“æ¼īѳʷµČ¼¶ĪŖ_____Ę·£¬ŌŚÉĻŹö“æ¼īŗ¬Įæ²ā¶ØÖŠ£¬½«CaCl2ČÜŅŗøÄĪŖBaCl2ČÜŅŗ£¬²ā¶ØĪó²ī»į¼õŠ”£®
¹¤Ņµ“æ¼ī±ź×¼£ŗ£ØNa2CO3% £© | |||
ÓŵČĘ· | Ņ»µČĘ· | ŗĻøńĘ· | “ĪĘ· |
”Ż95 | ”Ż80 | ”Ż75 | ”Ü40 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潚Źō²ÄĮĻ¹ć·ŗÓ¦ÓĆÓŚ¹¤Ņµ”¢Å©Ņµ”¢½»ĶØŗĶČÕ³£Éś»īµČĮģÓņ”£
£Ø1£©»ĘĶ”¢ÉśĢś¶¼ŹĒÉś»īÖŠ³£¼ūµÄĮ½ÖÖ_____£ØŃ”Ģī”°ŗĻ½š”±»ņ”°“潚Źō”±£©”£
£Ø2£©ĢåĪĀ¼ĘÖŠµÄ½šŹōŹĒ_____”£
£Ø3£©ĀĮÄĶøÆŹ“ŹĒŅņĪŖ±ķĆęŠĪ³É_____£ØĢī»ÆѧŹ½£©”£
£Ø4£©¹¤ŅµÓĆ³ąĢśæóŹÆĮ¶ĢśµÄ»Æѧ·½³ĢŹ½ĪŖ_____”£
£Ø5£©īŃŗĻ½šŹĒČĖŌģ¹ĒµÄÖŲŅŖ²ÄĮĻ”£ŅŖ±Č½ĻīŃ£ØTi£©ŗĶĢśµÄ½šŹō»ī¶ÆŠŌĒæČõ£¬ŅŌĻĀ·½·Ø²»ÄÜ“ļµ½ÄæµÄŹĒ_____”£
A ²éŌijõÖŠ»ÆѧæĪ±¾ÉĻµÄ½šŹō»ī¶ÆŠŌĖ³Šņ±ķ B ĄūÓĆ½šŹōīŃŗĶFeCl2ČÜŅŗ½ųŠŠŹµŃé
C ĄūÓĆ½šŹōĢśŗĶTiSO4ČÜŅŗ½ųŠŠŹµŃé D ĄūÓĆ½šŹōīŃ”¢ĢśÓėĻ”ĮņĖį½ųŠŠŹµŃé
£Ø6£©ŗ¬ÓŠŠæ6.5g”¢Ģś5.6g”¢Ķ6.4g”¢ĀĮ2.7gµÄ»ģŗĻ·ŪÄ©ÓėŅ»¶ØÖŹĮæµÄĻ”ĮņĖį³ä·Ö·“Ó¦ŗó£¬ÓŠ9.2g¹ĢĢåŹ£Óą£¬ŌņÉś³ÉĒāĘųÖŹĮæĪŖ_____g£¬ĖłµĆČÜŅŗÖŠČÜÖŹµÄÖŹĮæŹĒ_____g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
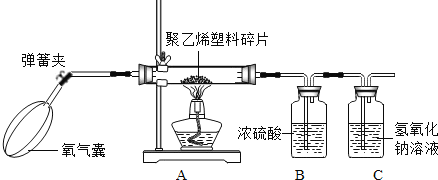
”¾ĢāÄæ”æČÕ³£Éś»īÖŠŹ¹ÓƵÄĖÜĮĻ“üÓŠÓĆ¾ŪŅŅĻ©ÖĘ³ÉµÄ£¬Ņ²ÓŠÓĆ¾ŪĀČŅŅĻ©ÖĘ³ÉµÄ”£Š”Ć÷Ķ¬Ń§ĢżĖµ°ü×°Ź³Ę·µÄĖÜĮĻ“üÓ¦øĆŹĒĒ°Õ߶ų²»ŹĒŗóÕߣ¬±ćÉč¼ĘĮĖŅ»øöŹµŃé·½°ø£¬ÓĆĘ½³£ŌŚ³¬ŹŠĀņ¶«Ī÷Ź±“ų»ŲĄ“µÄĖÜĮĻ“ü½ųŠŠĢ½¾æ£¬ŅŌŃéÖ¤Ęä³É·Ö”£
²éŌÄ׏ĮĻ£ŗ¾ŪŅŅĻ©Č¼ÉÕÉś³ÉCO2ŗĶH2O£»¾ŪĀČŅŅĻ©Č¼ÉÕ³żĮĖÉś³ÉCO2ŗĶH2OÖ®Ķā£¬»¹»įÓŠHClĘųĢå²śÉś”£
ŹµŃéĢ½¾æ£ŗŠ”Ć÷½«ŅŌĻĀŹµŃé×°ÖĆ°“ABCDĖ³ŠņĮ¬½ÓŗĆ£¬Č»ŗó½ųŠŠĢ½¾æ”£
(1)ŌŚŹµŃé¹ż³ĢÖŠČōB”¢C”¢D×°Öƶ¼²śÉśĆ÷ĻŌµÄĻÖĻó£¬ŌņøĆĖÜĮĻ“üŹĒÓĆ______ÖĘ³ÉµÄ”£(Ģī”°¾ŪĀČŅŅĻ©”±»ņ”°¾ŪŅŅĻ©”±)
ŹµŃé·“Ė¼£ŗĮ¬½ÓŹµŃé×°ÖĆŹ±£¬ÄÜ·ń½«×°ÖĆC”¢DĖ³Šņµ÷»»£æĒė¼ņŹö”£
“š£ŗ______ĄķÓÉŹĒ______
¼ĢŠųĢ½¾æ£ŗŠ”Ć÷ĪŖĮĖ²ā¶Ø¾ŪŅŅĻ©µÄ×é³É£¬Č”ĮĖ5.6g¾ŪŅŅĻ©ĖÜĮĻĖéʬ·ÅŌŚÓ²ÖŹ²£Į§¹ÜÖŠ£¬¹ÄČė³ä×ćµÄŃõĘųŹ¹Ö®Č¼ÉÕ£¬½«²śÉśµÄĘųĢåĶØČė×ćĮæµÄÅØĮņĖįŗĶĒāŃõ»ÆÄĘČÜŅŗÖŠ£¬²¢½«ŹµŃé½į¹ū¼ĒĀ¼ŌŚĻĀ±ķÖŠ”£ŹµŃé½į¹ū£ŗ
ŹµŃéĒ° | ŹµŃéŗó | |
B×°ÖƵÄÖŹĮæ/g | 213.6 | 220.8 |
C×°ÖƵÄÖŹĮæ/g | 200.2 | 217.8 |
(2)øł¾ŻŹµŃé½į¹ūæÉŅŌÅŠ¶Ļ£ŗ¾ŪŅŅĻ©Č¼ÉÕÉś³ÉµÄĖ®µÄÖŹĮæŹĒ______£»¶žŃõ»ÆĢ¼µÄÖŹĮæŹĒ______”£
(3)¾ŪŅŅĻ©ÖŠŹĒ·ńŗ¬ÓŠŃõŌŖĖŲ______(Ģī”°ÓŠ”±»ņ”°ĪŽ”±)£»Ģ¼ĒāŌŖĖŲµÄÖŹĮæ±ČĪŖ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
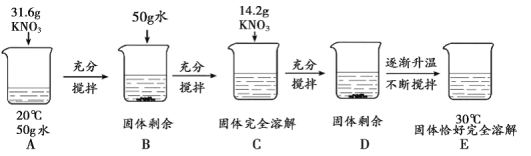
”¾ĢāÄæ”æt2”ꏱ£¬½«¼×”¢ŅŅø÷80g·Ö±š·Åµ½Ź¢ÓŠ100gĖ®µÄĮ½øöÉÕ±ÖŠ£¬³ä·ÖČܽāŗ󣬻Öø“µ½t2”ę£¬ĻÖĻóČēĶ¼£¬¼×ŗĶŅŅµÄČܽā¶ČĒśĻßČēĶ¼”£Ēė½įŗĻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©ÄÜĖµĆ÷¹ĢĢå¼×¶ŌÓ¦µÄČܽā¶ČĒśĻߏĒaµÄÖ¤¾ŻŹĒ_______”£
£Ø2£©ĻĀĮŠ¹ŲÓŚt2 ”ꏱ£¬¼×”¢ŅŅĖłµĆČÜŅŗµÄĖµ·Ø²»ÕżČ·µÄŹĒ______£ØĢīŠņŗÅ£©”£
A ČÜÖŹÖŹĮæ£ŗ¼×<ŅŅ B ŅŅĪŖ±„ŗĶČÜŅŗ
C ČÜÖŹÖŹĮæ·ÖŹż£ŗ¼×=ŅŅ D ½«ČÜŅŗ½µĪĀÖĮt1 ”ꏱ£¬¼×”¢ŅŅµÄČܽā¶ČĻąµČ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com