人类理想的能源之一是氢气,但是氢气在常温下密度小、难液化,贮存困难.有人研究提出,用金属锂(Li)与氢气在725℃时作用生成氢化锂粉末(LiH),将氢气贮存起来.需要时,随即将氢化锂与水反应即可放出大量氢气,同时生成氢氧化锂(LiOH).
(1)写出上述两步反应的化学方程式,并标出氢元素的化合价:________
(2)一种氢能源汽车每天消耗密度约为0.09g/L的氢气100L,则l kg氢化锂约可维持该汽车运行________ 天.
(1)氢气为单质所以氢气中氢元素的化合价为0,标在化学式的上面即可;锂化氢中锂元素化合价为+1价,氢元素化合价为-1价;水中氧元素化合价为-2价,氢元素化合价为+1价;氢氧化锂中锂化合价为+1价,氧元素化合价为-2价,氢元素的化合价为-1价;金属锂(Li)与氢气在725℃时作用生成氢化锂粉末(LiH),氢化锂与水反应即可放出大量氢气,同时生成氢氧化锂(LiOH).故(1)答案:
2Li+
 2
2
2Li

Li

+
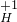 2
2O=LiO
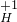
+
 2
2↑
(2)设l kg氢化锂与水反应生成的氢气质量为x
LiH+H
2O=LiOH+H
2↑
8 2
1000g x
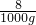
=
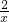
x=250g
汽车每天消耗的氢气的质量:0.09g/L×100L=9g
l kg氢化锂约可维持该汽车运行的天数为:
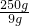
=27.8天.
答:l kg氢化锂约可维持该汽车运行27.8天
分析:(1)运用化合物中化合价代数和为0和单质中元素的化合价为0及题中信息用金属锂(Li)与氢气在725℃时作用生成氢化锂粉末(LiH),将氢气贮存起来.需要时,随即将氢化锂与水反应即可放出大量氢气,同时生成氢氧化锂(LiOH)解答.
(2)运用化学方程式LiH+H
2O=LiOH+H
2↑计算出l kg氢化锂与水反应生成的氢气的质量,然后除以汽车每天消耗的氢气的质量解答.
点评:本题考查了化学方程式的书写、元素的化合价和根据化学方程式的计算知识,综合性强侧重基础知识注重计算能力.

 2
2 2Li
2Li Li
Li +
+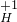 2O=LiO
2O=LiO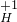 +
+ 2↑
2↑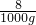 =
=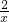
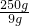 =27.8天.
=27.8天.
