
【题目】KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是

A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
科目:初中化学 来源: 题型:
【题目】理化知识在生产,生活中有广泛的应用。
(1)幼儿及青少年缺____________元素会患佝偻病和发育不良。
(2)天然气热水器燃烧的化学方程式为:____________
(3)金属在生活生产中有着非常广泛的应用,生铁和钢的性能不同,原因是_____不同。
(4)节日燃放的烟火中加入镁粉的原因是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
|
|
|
|
A.探究铁、镁金属活动性强弱 | B.探究二氧化碳与水是否发生反应 | C.探究不同溶剂中物质溶解性大小 | D.探究温度对分子运动快慢的影响 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图示与相应的文字描述完全符合的是

A.图A是加水稀释NaOH溶液
B.图B是加热分解KMnO4固体
C.图C是向饱和石灰水中加入CaO
D.图D是向稀硫酸和硫酸铜的混合溶液中加入KOH溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为_______。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是_______(填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途:_______(写一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CO2的捕集与资源化利用是化学研究的热点。
(1)控制CO2的排放,是为了减缓_________效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度_______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的CO2,该方法以CaO捕集CO2,将所得产物在高温下煅烧可重新获得CaO,高温煅烧时反应的化学方程式为_______,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的_________性。
(3)对CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过程主要改变的是_______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中CO2的体积分数与溶液pH的关系如图-1所示。
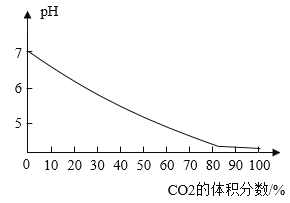
①气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中_______浓度增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内CO2气体含量的变化,举出一种可通过颜色变化用于该智能化包装的物质__________________。
(5)已知一定条件下CO2与H2以质量比11:2反应可生成CH4。与该反应类似,不同条件下,CO2与H2反应也能生成甲醇(CH4O)。生成甲醇时参加反应的CO2与H2的质量比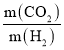 =___________。
=___________。
(6)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光合有效辐射进行测量,结果见图-2和图-3。通过测量其一年内每天空气中CO2含量等数据,分析所得碳交换的结果见图-4。碳交换以每月每平方米植物吸收或释放CO2的质量表示,正值为净吸收CO2,负值为净释放CO2。
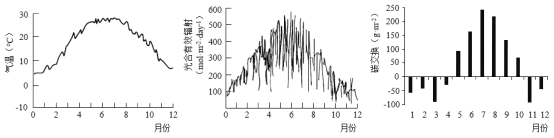
①由上图可推测,影响公园中植物与大气碳交换的因素有_________。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天_________的变化。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答下列问题:
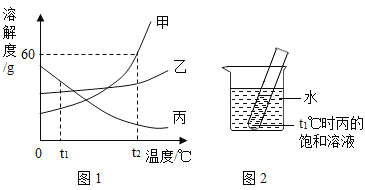
(1)t1℃时,甲、乙、丙三种物质中溶解度最大的是____。
(2)t2℃时,甲物质的溶解度为____g。
(3)将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序为_______。
(4)如图2,t1℃时,若向烧杯中加入足量的_____(填字母序号)并使之充分溶解,在试管中可观察到有晶体析出。
A 氯化钠 B 氢氧化钠 C 硝酸铵
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2020年6月8日是第12个“世界海洋日”,海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料——氯化镁,设计方案如下:
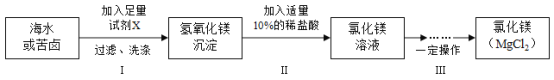
(信息)
(1)海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、KCl等。
(2)苦卤是海水晒盐后剩余的溶液。
(3)如下表是某品牌不同碱的价格。
试剂 | NaOH | Ca(OH)2 | Ba(OH)2 | KOH |
价格(元/吨) | 2400 | 850 | 5300 | 5500 |
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是______。
(2)在工业生产中为了降低成本,试剂X最好选择表格中的______。
(3)该方案制取氯化镁时,要经历步骤I和步骤II两步转化,其主要目的是____。
(4)小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤III中氯化镁没有损失,求步骤II中消耗稀盐酸的质量___。(写出计算步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com