
| A. | 10克 | B. | 8克 | C. | 17克 | D. | 16克 |
分析 根据已有的知识进行,氧化铜、氢氧化铜反应生成硫酸铜,硫酸铜与硫酸不反应,根据硫酸的质量即可求出生成硫酸铜的质量.
解答 解:假如是氧化铜和硫酸铜的混合物
CuO+H2SO4=CuSO4+H2O,
80 98 160
8g 9.8g 16g
则原混合物中硫酸铜的质量为10g-8g=2g,则所得溶液中溶质的质量为18g,
假如是氢氧化铜和硫酸铜的混合物
Cu(OH)2+H2SO4=CuSO4+2H2O,
98 98 160
9.8g 9.8g 16g
则原混合物中硫酸铜的质量为10g-9.8g=0.2g,则所得溶液中溶质的质量为0.2g+16g=1.2g,
由于是三者混合物,则对应的溶液中的溶质的质量是大于16.2g小于18g,
故选C
点评 本题考查了根据化学方程式的计算,完成此题,可以依据反应的化学方程式结合题干提供的数据进行.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:初中化学 来源: 题型:选择题
| A. | TiO2 | B. | Ti2O2 | C. | Ti2O | D. | Ti2O5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
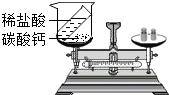 如图是探究质量守恒定律的实验装置图,回答下列问题:
如图是探究质量守恒定律的实验装置图,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若甲是镁,丙是氢气,则乙一定是稀硫酸 | |
| B. | 若甲、乙、丙分别是酸、碱、盐,则丁一定是水 | |
| C. | 若丙、丁分别是化合物和单质,则该反应一定是置换反应 | |
| D. | 若甲乙质量均为10g,则生成丙和丁的质量总和一定是20g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
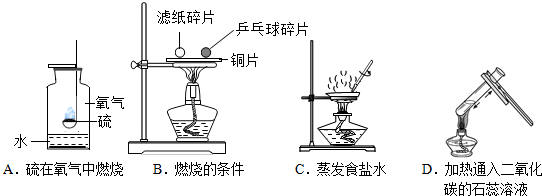
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
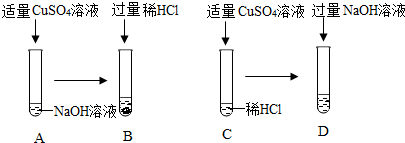
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
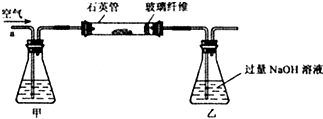
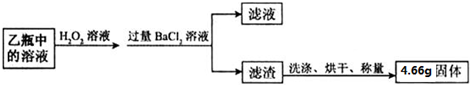
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
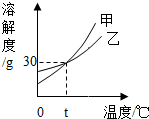 如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )
如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )| A. | t℃时甲和乙的溶解度相等 | |
| B. | t℃时30g乙加到100g水中形成饱和溶液 | |
| C. | 从甲的饱和溶液中得到甲可用降温结晶的方法 | |
| D. | 甲的溶解度大于乙的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com