
| 操作步骤 | 现象记录 | 反应的化学方程式 |
| 取两支试管,分别往试管中加入2mL样品1、2,再往其中滴入盐酸 | 样品1: | HCl+NaOH═NaCl+H2O |
| 样品2:溶液中出现气泡 |
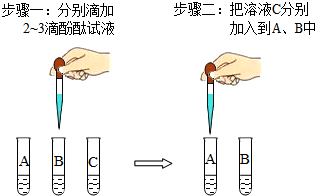 盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动:
盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动:| 操作步骤 | 现象记录 | 反应的化学方程式 |
| 取两支试管,分别往试管中加入2mL样品1、2,再往其中滴入盐酸 | 样品1:无现象 | HCl+NaOH═NaCl+H2O |
| 样品2:溶液中出现气泡 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ |


科目:初中化学 来源: 题型:
| A、金属钾能与硫酸锌溶液发生化学反应得到金属锌 |
| B、金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大 |
| C、在空气中铝比铁更耐腐蚀,说明铁的活动性比铝强 |
| D、金属铜与氯化银反应得到金属银 |
查看答案和解析>>
科目:初中化学 来源: 题型:
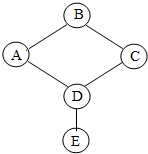 A、B、C、D、E分别是氧气、稀硫酸、硫酸铜溶液、细铁丝、氢氧化钠溶液中的一种物质,用五个圆表示这五种物质,图中连线两端的物质可以相互反应.请回答下列问题:
A、B、C、D、E分别是氧气、稀硫酸、硫酸铜溶液、细铁丝、氢氧化钠溶液中的一种物质,用五个圆表示这五种物质,图中连线两端的物质可以相互反应.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
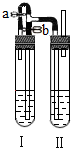 某小组同学用以下两种方法可以制得白色的Fe(OH)2沉淀.
某小组同学用以下两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:
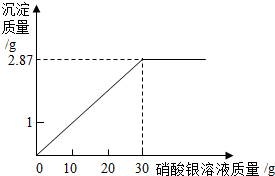 小强为测定某氯化钠溶液中溶质的质量分数,做了如下实验:向烧杯中加入10g该氯化钠溶液,然后向其中滴加硝酸银溶液,滴加硝酸银溶液的质量与产生沉淀的质量关系如图所示.已知:NaCl+AgNO3═NaNO3+AgCl↓.
小强为测定某氯化钠溶液中溶质的质量分数,做了如下实验:向烧杯中加入10g该氯化钠溶液,然后向其中滴加硝酸银溶液,滴加硝酸银溶液的质量与产生沉淀的质量关系如图所示.已知:NaCl+AgNO3═NaNO3+AgCl↓.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
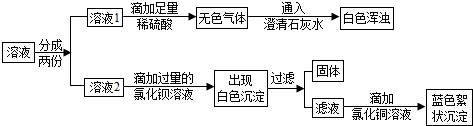
查看答案和解析>>
科目:初中化学 来源: 题型:
| 原子结构示图 | 核电核数 | 电子层数 | 最外层电子数 | 核外电子数 | 元素类别 |
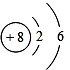 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com