
| A. | 生产生活中,可用加热高锰酸钾的方法制得大量的氧气 | |
| B. | 鱼类能在水中生存,证明氧气极易溶于水 | |
| C. | 木炭在空气中灼烧红热,在氧气中燃烧并发出白光,现象不同与氧气的浓度有关 | |
| D. | 空气中氧气的质量分数约为21% |
分析 A、根据在实验室中,可用加热高锰酸钾的方法制氧气解答;
B、根据氧气不易溶于水解答;
C、根据促进物质燃烧的因素解答;
D、根据空气中氧气的体积分数约为21%解答.
解答 解:
A、在实验室中,可用加热高锰酸钾的方法制氧气,生产生活中,可用分离液态空气的方法制得大量的氧气,故错误;
B、氧气不易溶于水,鱼类能在水中生存,说明水中溶有少量氧气,故错误;
C、氧气的浓度越大,物质燃烧越剧烈,木炭在空气中灼烧红热,在氧气中燃烧并发出白光,现象不同与氧气的浓度有关,故正确;
D、空气中氧气的体积分数约为21%,不是质量分数,故错误.
答案:C
点评 解答本题要掌握促进可燃物燃烧的方法等方面的知识,只有这样才能对燃烧方面的问题做出正确的判断.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将工业废气处理后再排放 | B. | 使用绿色公共交通出行 | ||
| C. | 随意大量燃放鞭炮 | D. | 开发和利用各种清洁能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
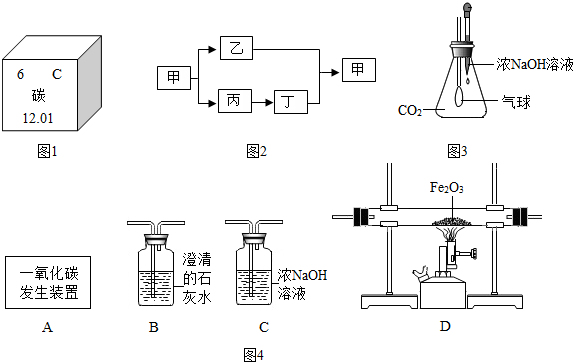
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁条在空气中燃烧 | B. | 石灰浆摸墙壁上后有水珠产生 | ||
| C. | 铜首置于潮湿的空气中表面变绿 | D. | 活性炭吸附冰箱内异味 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水-生命之源
水-生命之源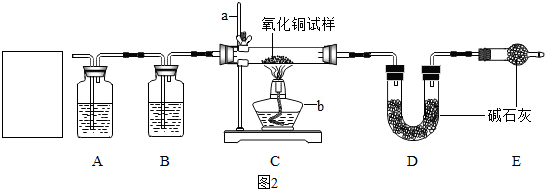
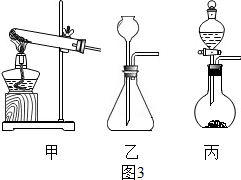
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com