
| 选项 | 物质 | 杂质 | 所用试剂和操作方法 |
| A | Na2CO3溶液 | Na2SO4溶液 | 加入过量的Ba(NO3)2溶液,过滤 |
| B | H2 | HCl | 加饱和的NaHCO3溶液,浓硫酸 |
| C | NaCl固体 | 细沙 | 加足量的水溶解、过滤,蒸发结晶 |
| D | 铁粉 | Fe2O3 | 加入适量的稀盐酸,过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、Na2SO4溶液和Na2CO3溶液均能与过量的Ba(NO3)2溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、HCl能与饱和的NaHCO3溶液反应生成氯化钠、水和二氧化碳,能除去杂质但引入了新的杂质二氧化碳,不符合除杂原则,故选项所采取的方法错误.
C、氯化钠易溶于水,细沙难溶于水,可采取加水溶解、过滤、蒸发结晶的方法进行分离除杂,故选项所采取的方法正确.
D、Fe2O3和铁粉均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
故选:C.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:初中化学 来源: 题型:选择题
| A. |  将一定量的60℃硝酸钾饱和溶液冷却至室温 | |
| B. |  向相同质量和相同质量分数的稀盐酸中,分别加入过量 Cu(OH)2和CuO 固体 | |
| C. | 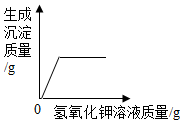 向一定量的氯化铁和氯化钾的混合溶液中,逐滴加入过量的氢氧化钾溶液 | |
| D. |  向相同质量和相同质量分数的稀硫酸中,分别加入过量的镁粉和铝粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
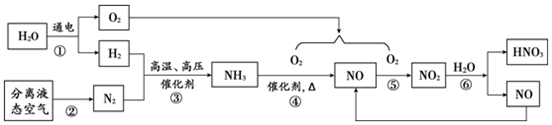
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
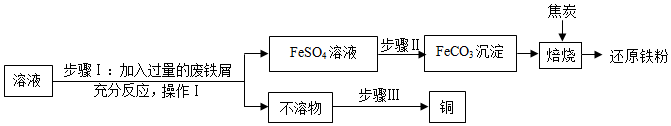
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 化学反应方程式 | 反应类型 | 气体性质 |
| A | Fe+H2SO4=FeSO4+H2↑ | 置换反应 | 还原性 |
| B | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑ | 分解反应 | 可燃性 |
| C | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | 化合反应 | 氧化性 |
| D | CaCO3+2HCl=CaCl2+H2O+CO2↑ | 复分解反应 | 酸性 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 金属材料广泛应用于生产生活中.
金属材料广泛应用于生产生活中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com