
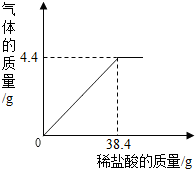
 为测定混有少量氯化钠的碳酸钠的固体中碳酸钠的质量分数,向盛有12g该混合物的烧杯中逐滴滴加稀盐酸直至无气体生成,发生反应后生成的物质是氯化钠、水和二氧化碳.加入的稀盐酸与生成的二氧化碳质量关系如右图所示,试计算:
为测定混有少量氯化钠的碳酸钠的固体中碳酸钠的质量分数,向盛有12g该混合物的烧杯中逐滴滴加稀盐酸直至无气体生成,发生反应后生成的物质是氯化钠、水和二氧化碳.加入的稀盐酸与生成的二氧化碳质量关系如右图所示,试计算:分析 根据题给的条件可以知道所发生的反应为碳酸钠和盐酸的反应,而生成二氧化碳气体的质量为4.4g,可以据此来分析求算参加反应的碳酸钠的质量和生成的氯化钠的质量.
解答 解:根据题意可知,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,所以生成的气体就是二氧化碳,二氧化碳的质量为4.4g;
设碳酸钠的质量为x,生成氯化钠的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
$\frac{106}{x}=\frac{117}{y}=\frac{44}{4.4g}$
解得:x=10.6g,y=11.7g
该样品中NaCl的质量=12g-10.6g=1.4g
(1)混合物中碳酸钠的质量分数为:$\frac{10.6g}{12g}×$100%≈88.3%
(2)所得溶液中NaCl的质量为:1.4g+11.7g=13.1g
答案:
(1)混合物中碳酸钠的质量分数为88.3%;
(2)实验完毕后所得液体中的氯化钠的总质量是13.1g
点评 本题通过计算的形式考查了碳酸盐与盐酸的反应,难度不大,关键是正确理解反应的原理.


科目:初中化学 来源: 题型:解答题
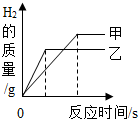 某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(如图).分析图象得到的以下结论中.
某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(如图).分析图象得到的以下结论中.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | (100-a)% | B. | (100-2a)% | C. | (100-3a)% | D. | (100-4a)% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某品牌碳酸钠试剂中含有少量氯化钠杂质,为测定试剂中碳酸钠的质量分数,取13g样品于烧杯中,加入154.4g水充分溶解,再逐滴滴入7.3%的盐酸溶液,所加盐酸溶液的质量与产生气体质量的关系如图所示.请计算:
某品牌碳酸钠试剂中含有少量氯化钠杂质,为测定试剂中碳酸钠的质量分数,取13g样品于烧杯中,加入154.4g水充分溶解,再逐滴滴入7.3%的盐酸溶液,所加盐酸溶液的质量与产生气体质量的关系如图所示.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
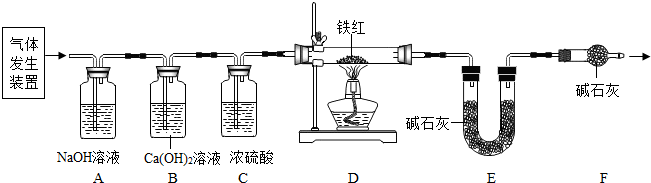
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com