
分析 根据质量守恒定律,由反应前后物质的总质量的差求得反应放出氢气的质量;
利用锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出参与反应的锌的质量(即样品中锌的质量)和生成硫酸锌的质量.
解答 解:
根据质量守恒定律,反应放出氢气的质量=74.2g+8g-82g=0.2g;
设参与反应的锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
$\frac{65}{x}=\frac{161}{y}=\frac{2}{0.2g}$
x=6.5g
y=16.1g
(1)杂质的质量=8g-6.5g=1.5g
(2)完全反应后生成物溶液中溶质的质量分数为:$\frac{16.1g}{82g-1.5g}×$100%=20%
答案:
(1)1.5;
(2)反应后所得溶液的溶质质量分数为20%.
点评 此题是根据化学方程式进行计算的考查题,解题的关键是利用反应前后的质量之差对相关的物质质量确定关系;


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:推断题
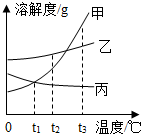 如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 天平保持平衡,左边烧杯中,酸没有剩余,镁可能有剩余 | |
| B. | 天平保持平衡,右边烧杯中,酸没有剩余,铝一定有剩余 | |
| C. | 天平失去平衡,左边烧杯中,酸一定剩余,镁一定没剩余 | |
| D. | 天平失去平衡,右边烧杯中,酸可能剩余,铝一定没剩余 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所加物质或方法 |
| A | 提纯硫酸钠中的硝酸钠 | 溶解、加适量的氯化钡溶液,过滤,蒸发 |
| B | 除去氧化铜中的碳粉 | 在足量的空气中灼烧 |
| C | 除去CO2中少量的HCl | 将混合气体通入饱和碳酸氢钠溶液、再通入浓硫酸 |
| D | 鉴别NH4NO3固体和NaOH固体 | 加水溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg-金属镁 | B. | 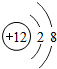 -镁原子 -镁原子 | ||
| C. | $\stackrel{+2}{Mg}$O-氧化镁中镁元素为+2价 | D. | N2-1个氮分子由2个氮原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 参加反应的甲、乙两种物质质量比为7:4 | |
| B. | 反应前后分子的个数没有改变 | |
| C. | 一个X分子中含有三个原子 | |
| D. | 该反应属于化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:
实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:| 实验操作 | 实验现象 |
| ①取少重该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀全部溶解. |
| 实验操作 | 实验现象 |
| 取上述无色溶液少许于试管中,滴加少量的稀盐酸 | 溶液中没有气泡产生(或有气泡产生),该瓶无色溶液是硫酸钠溶液(或碳酸钠溶液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com