
【题目】某化学兴趣小组在实验室里进行木炭还原氧化铜的实验。
(实验1)装置如图。
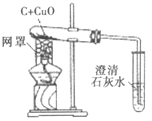
(1)木炭还原氧化铜的化学方程式为__,当碳与氧化铜的质量比为__(写最简整数比)时恰好完全反应。
(2)下列有关本实验的说法正确的是____(填字母)。
A 酒精灯加网罩以使火焰集中并提高温度
B 氧化铜发生了还原反应,木炭发生了氧化反应
C 观察到石灰水变浑浊即可证明氧化铜被还原了
D 反应后先撤出导气管,待试管冷却后再把其中的粉末倒出
(提出问题)实验1中,加热5分钟后仅能得到混有少量红色固体的黑色粉末。如何让木炭还原氧化铜时得到更多的铜呢?
(实验2)该小组同学在老师的指导下改进了实验,装置如图,加热2分钟后即得到紫红色有金属光泽的块状固体,且无黑色固体剩余。
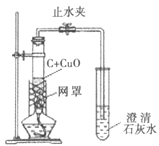
(1)刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是__。
(2)本实验所用的木炭与氧化铜的质量比为1︰10,碳需要略过量才能使氧化铜全部被还原,其主要原因是____。
(3)反应物放入试管后要尽量压实,并将试管竖直进行加热,使其下部完全被外焰包围,受热均匀,获得持续的高温。
(4)反应后关闭止水夹,让产物自然冷却,这时试管里残余的________就成了保护气。
(5)加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是________热量的。
(查阅资料)木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(拓展探究)将实验2得到的紫红色有金属光泽的块状固体全部研磨成粉末。
(1)将全部粉末放入烧杯中,加入足量稀硫酸,充分反应后,观察到______,证明实验2得到的铜中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.52g。
(2)已知实验2使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为______(计算结果保留一位小数)。
【答案】C+2CuO![]() 2Cu+CO2↑ 3︰40 ABD 增大了反应物的接触面积 有少量木炭会与试管中的氧气反应 二氧化碳 放出 溶液变蓝 88.9%
2Cu+CO2↑ 3︰40 ABD 增大了反应物的接触面积 有少量木炭会与试管中的氧气反应 二氧化碳 放出 溶液变蓝 88.9%
【解析】
(1) 木炭还原氧化铜的化学方程式为C+2CuO![]() 2Cu+CO2↑;故填写:
2Cu+CO2↑;故填写:
C+2CuO![]() 2Cu+CO2↑;
2Cu+CO2↑;
由木炭还原氧化铜的化学方程式可得,碳与氧化铜的质量比为:12:2 (64+16)=3:40;
(2)A、酒精灯加网罩以使火焰集中并提高温度,故符合题意;
B、氧化铜发生了还原反应,木炭发生了氧化反应,故符合题意;
C、观察到石灰水变浑浊不可证明氧化铜被还原了,因为在高温条件下,木炭与氧气也会反应生成二氧化碳,使澄清石灰水变浑浊,故不符合题意;
D、反应后先撤出导气管,待试管冷却后再把其中的粉末倒出,故符合题意
(3) 刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是增大了反应物的接触面积,故填写:增大了反应物的接触面积;
(4) 碳需要略过量才能使氧化铜全部被还原,其主要原因是有少量木炭会与试管中的氧气反应,故填写:有少量木炭会与试管中的氧气反应;
(5) 木炭还原氧化铜产生二氧化碳,反应后关闭止水夹,让产物自然冷却,这时试管里残余的二氧化碳就成了保护气,故填写:二氧化碳;
(6) 加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是放出热量的,故填写:放出;
(7) 氧化亚铜溶于稀硫酸会发生反应,生成硫酸铜,硫酸铜溶液为蓝色,故观察到溶液变蓝,证明实验2得到的铜中含有氧化亚铜,填写:溶液变蓝;
(8)解:设氧化亚铜与硫酸反应生成的铜的质量为x
Cu2O+H2SO4=CuSO4+Cu+H2SO4
144 160 64
![]()
![]() x
x
![]() 硫酸铜中铜的质量为:
硫酸铜中铜的质量为:![]() ⅹ
ⅹ![]() =x
=x
2.00g氧化铜中铜的质量为:2.00gⅹ![]() =1.6g
=1.6g
根据质量守恒定律的实质:化学反应前后元素质量不变的原则,故:x+1.52g=1.6g,x=0.08g
紫红色有金属光泽的块状固体中氧化亚铜的质量为:![]() =0.18g
=0.18g
紫红色有金属光泽的块状固体的质量为:0.18g+1.52g-0.08g=1.62g
单质铜的质量分数为:![]() ⅹ100%≈88.9%
ⅹ100%≈88.9%
答:实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为88.9%


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G都是初中化学中常见物质,A是白色固体,B和F是黑色固体,G和H是无色液体,E在D中燃烧的现象非常剧烈,火星四射。B在反应③中作催化剂。它们之间的转换关系如图所示:
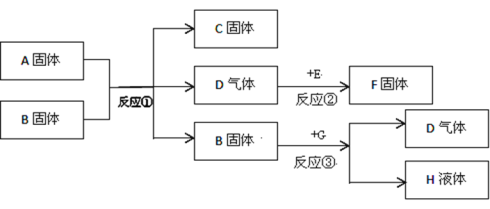
(1)写出上述物质的化学式:A________;G___________。
(2)写出上述①②③反应的化学方程式并在括号里注明该反应的基本反应类型。
①____________________ (____________)反应
②__________________________ (____________)反应
③____________________________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上粗盐(含MgCl2、CaCl2、Na2SO4等杂质),精制的工艺流程如下:
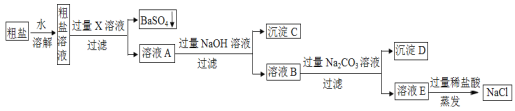
(1)X中含有的阳离子是________________;沉淀C的化学式是_____________。
(2)写出生成沉淀D的一个化学方程式_______________________________________。
(3)溶液E中加过量稀盐酸的作用是________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取敞口放置的氧化钙样品22g,加入足量盐酸,产生4.4g CO2,再向剩余溶液中足量的Na2CO3溶液,充分反应后,过滤得到沉淀质量为30g。下列说法正确的是( )
A. 样品固体中含有三种元素
B. 样品固体中碳元素的质量为1.6g
C. 样品固体中一定不含氢元素
D. 氧化钙在空气中发生的反应包含两种基本类型
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包金属粉末,可能由Mg、Al、Zn、Fe中的一种或几种组成。向2.4g该金属粉末中加入100g稀硫酸,充分反应,生成0.2g H2,金属无剩余。下列说法正确的是
A. 金属粉末中一定含有MgB. 金属粉末中一定含有Al
C. 金属粉末中可能含有四种金属D. 稀硫酸的质量分数为9.8%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中化学常见物质。A是日常生活中最常见的金属;B溶液呈现蓝色,常用其配制农药波尔多液;B与C反应生成D和E;其中D为蓝色沉淀,F的固态常被称为“干冰”且能与C反应生成G和H,G俗称为纯碱。
(1)A和F的化学式分别为_____、_____。
(2)实验室检验气体F的试剂为_____。
(3)C的俗名为_____(只要写一个),A与B反应的类型是_____反应。
(4)B与C反应的化学方程式为_____,G转化为C的化学方程式_____。
(5)物质D在加热条件下能分解成两种氧化物,请写出D受热分解的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学城中学一化学兴趣小组选用如图所示装置,进行CO2的制取和性质实验,请你根据所学知识,依图回答下列问题:
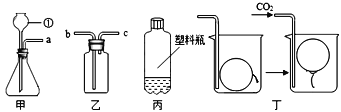
(1)写出图中仪器①的名称_______。
(2)装置甲中反应的化学方程式为_______。
(3)用装置乙排空气收集二氧化碳,验满时,燃着木条应放在_______ (填“b”或“c”)端。
(4)用图丙所示的质地较软的塑料瓶收集满CO2,再倒入一定量的紫色石蕊溶液,立即旋紧瓶盖,振荡,观察到的现象是_______。
(5)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是_______。
(6)实验结束后,甲装置中仍然有固体,写出该装置中溶液里含有的微观粒子符号_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是元素周期表的另一种画法﹣﹣塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:

(1)图①中元素X对应图②中的_____是同种元素(填图②中的字母序号)。
(2)图②中,A粒子在反应中容易得到1个电子,形成的粒子符号为_____;图②中属于同一族的元素是_____(填图②中的字母序号)。
(3)已知一种化合物由离子构成且甲、乙、丙、丁四份不同浓度的该物质的水溶液中的离子个数如图③所示,该物质的化学式为_____(填字母)
A CaCl2 B NaCl C CuSO4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是( )
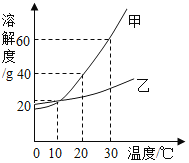
A. 10℃时,甲、乙两种物质的饱和溶液中溶质的质量相同
B. 蒸发溶剂可使接近饱和的乙溶液变成饱和溶液
C. 30℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为80g
D. 10℃时,将两种饱和溶液升温至30℃,溶液中溶质的质量分数都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com