
【题目】活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品。用粗ZnO制备活性ZnO的生产工艺流程做如下图所示。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:
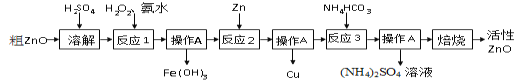
【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 | ||||
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是___________ __________ _ 。
(2)写出ZnO与加稀硫酸反应的化学方程式 。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2 、Zn (OH)2 ,该步骤需控制溶液pH的范围是 ,操作A的名称是 。
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3yZn(OH)2zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3yZn(OH)2zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3 ![]() ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2 ![]() ZnO+H2O
ZnO+H2O
【实验步骤】
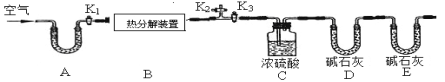
①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
装置C的质量(/g) | 装置D的质量(/g) | |
实验前 | 198.4 | 235.7 |
实验后 | 209.2 | 244.5 |
【实验分析及数据处理】
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 。
(2)第⑤步继续通空气的目的是 。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3yZn(OH)2zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为 。
【答案】【问题讨论】(1)使氧化锌粗品充分反应 (2)ZnO+H2SO4==ZnSO4+H2O
(3)3.2~5.2 过滤 (4)置换
Ⅱ测定碱式碳酸锌的化学式 ①气密性 ②打开活塞K1、K2 ,关闭 K3
【实验分析及数据处理】(1)除去鼓入空气中的二氧化碳和水蒸气
(2)使反应生成的二氧化碳和水蒸气被完全吸收
(3)防止空气中的二氧化碳和水蒸气进入装置D 偏大
(4) 1:2:1 ZnCO32Zn(OH)2H2O=3ZnO + CO2 ↑+2H2O
【解析】
试题分析:【问题讨论】(1) 溶解前将氧化锌粗品粉碎成细颗粒,目的是:增大反应物的接触面积,使氧化锌粗品充分反应
(2) ZnO与稀硫酸反应的化学方程式:ZnO+H2SO4==ZnSO4+H2O
(3)根据资料3中,几种物质沉淀的PH,反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2 、Zn (OH)2 ,该步骤需控制溶液pH的范围是3.2~5.2,操作A是将不溶性固体与液体分离开来,故名称是过滤
(4)反应2是加入锌将铜置换出来,属于置换反应
Ⅱ测定碱式碳酸锌的化学式①按图连接好装置,对反应过程中有气体生产的反应,为了保证气体不泄露,故要检查装置的气密性,②打开活塞K1、K2,关闭 K3,缓缓鼓入空气数分钟
【实验分析及数据处理】(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是除去鼓入空气中的二氧化碳和水蒸气,以免影响产生的二氧化碳和水蒸气质量
(2)第⑤步继续通空气的目的是将残留在装置内的二氧化碳和水蒸气全部排入到质量C、的中,使反应生成的二氧化碳和水蒸气被完全吸收
(3)E处碱石灰的作用是防止空气中的二氧化碳和水蒸气进入装置D,若没有此装置,则空气中的二氧化碳会进入到装置D中,使测得二氧化碳的质量偏大
(4)装置C的作用是吸收生成的水,实验前后质量的质量差=209.2g-198.4g=10.8g,即反应生成水的质量,装置D的作用是吸收生成的二氧化碳,实验前后质量的质量差=244.5g-235.7g=8.8g,即反应后生成二氧化碳的质量,自然可以得出热分解装置中剩余的物质质量=68.2g-8.8g-10.8g=48.6g,即生成的ZnO质量,根据反应ZnCO3△ZnO+CO2↑中ZnCO3、ZnO、CO2 微粒个数关系,可得出x=0.2,ZnO的质量=0.2×81=16.2g,则Zn(OH)2△ZnO+H2O这个反应得到的ZnO质量=48.6g-16.2g=32.4 g,根据反应中Zn(OH)2、ZnO、H2O微粒个数关系,可得出y=0.4,H2O的质量=0.4×18=7.2g,故原来水的质量=10.8g-7.2g=3.6g,即微粒个数=0.2,故xZnCO3yZn(OH)2zH2O中x:y:z的最简比=0.2:0.4:0.2=1:2:1,根据上面求算出来的x、y、z的值,碱式碳酸锌受热分解的化学方程式为:ZnCO32Zn(OH)2H2O△3ZnO + CO2 ↑+2H2O


科目:初中化学 来源: 题型:
【题目】已知A—H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且C能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据右图所示的转化关系(图中反应条件均已略去),请回答:
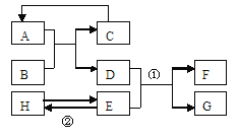
(1)写出下列物质的化学式:B 、C ;
(2)写出下列反应的化学方程式:
① ; ② ,反应②的基本反应类型是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)某实验小组在一定量的石灰水中通入CO2 ,产生沉淀的质量与通入CO2 质量的关系如下图所示,已知反应:CaCO3+H2O+CO2=Ca(HCO3)2 ,Ca(HCO3)2 易溶于水。
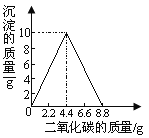
(1)请描述实验过程中可能观察到的现象: (2分)。为使溶液的溶质在整个实验过程中为最大值,理论上至少应通入CO2 质量是 。
(不考虑CO2 气体在水中的溶解)
(2)请计算通CO2气体前石灰水中溶质的质量。(请写出计算过程,2分)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了如图的“吸金球”,“吸金球”是装入一些“吸金”物质的纱袋,把“吸金球”浸入电镀液,能“吸”出盐溶液中的金,据上所述,“吸金球”中的“吸金”物质可能是( )

A.活性炭(C)B.磁石(主要成分是Fe3O4)
C.铁屑(Fe)D.胆矾(CuSO45H2O)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)某同学设计了利用废旧电池中的锌皮制取干燥、纯净的H2,并验证该气体中杂质的实验。请回答下列问题:(提示:无水CuSO4遇水变蓝色)
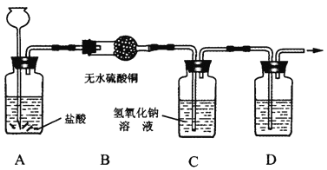
(1)若实验中看到的现象是________________,可证明产生的气体中含有水蒸汽,除此之外还可能含有的气体杂质的化学式是________________。
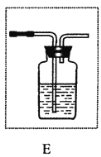
(2)如果用E装置检验该杂质,则E中所放试剂的名称为________________,E应连接在上述装置中________________(填字母)之间。
(3)装置C的作用是________________,D中所放试剂的名称为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了提高城市居民节水意识,从1992年开始,每年5月15日所在的那一周为“全国城市节水宣传周”。今年是5月10日到5月16日,市有关部门呼吁广大市民“像北方缺水城市一样珍惜水资源”,下列做法中有利于节约水资源的是:
A、洗脸、涮牙时不间断地放水 B、洗澡擦肥皂时不关喷头,任水流
C、任由水龙头漏水而不及时修理 D、洗菜、淘米的水用来浇花
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】追求化学家的足迹.
(1)舍勒是最早制得氧气的化学家之一,他获得氧气的方法主要有以下两类:
a.加热分解硝酸钾、氧化汞、硝酸银等
b.用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)![]() 2MnSO4+2X+O2↑
2MnSO4+2X+O2↑
①a中反应物均可制得氧气,因为它们组成的共同点: ;
②b中物质X化学式为 ;
③写出实验室制取氧气的一个化学方程式: .
(2)舍勒由于受“燃素说”的影响(即认为一切可以燃烧的物质都是由灰和“燃素”组成的,物质燃烧后剩下的是灰,而燃素本身变成了光和热,逸散到空中去了),导致“氧气”从他的鼻尖下溜走.化学家拉瓦锡结合大量实验事实,否定了“燃素说”认为的“物质燃烧后质量应当减轻”的观点,真正发现了氧气.
①写出铁丝在氧气中燃烧的化学方程式: ;
②以铁燃烧的事实,指出上述“燃素说”的谬误: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com