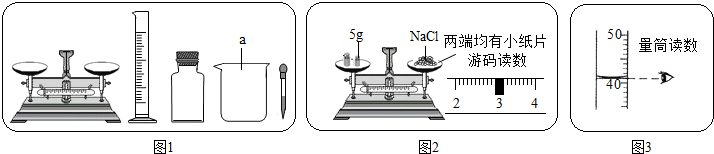
解:(1)由图示可以看出,该仪器为烧杯,故答案为:烧杯;
(2)配制溶液的步骤为:计算、称量、溶解、装瓶,故答案为:④③①②;
(3)该图表示配制溶液全过程需用的所用仪器,称量使用托盘天平、量筒,溶解时还会用到烧杯和玻璃棒,故答案为:玻璃棒;
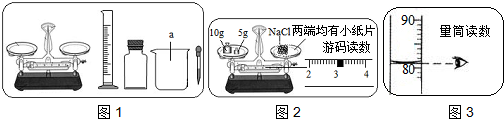
(4)由图示可以看出托盘天平的使用错误,物码放反了,由正确称量:“物质质量=砝码质量=游码质量”得出:药品实际质量=砝码质量-游码质量=15g-3g=12g,故答案为:药品和砝码的位置放反了 12;
(5)由图示中所示数据可得,每小格所表示的质量为1mL,水的体积为82mL,再由水的密度1g/mL,由公式m=ρV得出水的质量为:82mL×1g/mL=82g,由托盘天平中砝码与游码的质量可知,该实验欲称药品质量为:10g+5g+3g=18g,溶液质量为:82g+18g=100g,由溶质质量分数的计算公式得溶质质量分数为:

×100%=18%,故答案为:18%
(6)1)、2)、3)①粗盐提纯的第一步是溶解,搅拌时要用到玻璃棒,以加快粗盐溶解.
②加入过量BaCl
2溶液,与Na
2SO
4发生反应,生成BaSO
4沉淀和NaCl;
③加过量NaOH溶液,与MgCl
2发生反应,生成Mg(OH)
2沉淀和氯化钠;
④加过量Na
2CO
3溶液,与CaCl
2和①中过量BaCl
2溶液发生反应,生成CaCO
3沉淀和BaCO
3沉淀和氯化钠;
⑤过滤,滤出前面生成的沉淀及泥沙;
⑥加适量盐酸,与③中过量NaOH溶液和②中过量Na
2CO
3溶液发生反应,生成氯化钠、水和二氧化碳气体.
⑦蒸发、结晶,得到精盐.
4)若用氢氧化钾代替氢氧化钠则会引入新的杂质--氯化钾.
故答案为:
(1)烧杯 (2)④③①②(3)玻璃棒 (4)药品和砝码的位置放反了 12 (5)18%
(6)1)加快粗盐溶解; 2)Na
2SO4,NaOH、Na
2CO
3; 3)CaCO
3、BaCO
3; 4)会引入新杂质KCl.
分析:(1)认识常见的仪器;
(2)依据配制溶液的步骤:计算、称量、溶解、装瓶,对照选项进行解答;
(3)先由图示判断该步是什么操作,再由操作判断所用仪器,最后确定所缺仪器;
(4)依据托盘天平的使用判断操作正误,由正确称量:“物质质量=砝码质量=游码质量”得出物码放反的计算公式,进而得出实际质量;
(5)由图示中所示数据计算每小格所表示的质量,进而得出正确结果,由溶质质量分数的计算公式求出所需结果.在计算溶质质量分数时关键是找准实际氯化钠的质量,而不是所称量的氯化钠的质量;
(6)粗盐中的MgCl
2、CaCl
2、Na
2SO
4都溶于水,要想将杂质除去必须将MgCl
2、CaCl
2和Na
2SO
4转化为沉淀,连同泥沙一起过滤除去
1)根据溶解中玻璃棒分析作用;
2)从加入的物质中的离子角度分析;
3)从④步前的溶液中的离子角度分析;
4)可以从复分解反应得原理以及加入的物质引入的离子角度分析.
点评:本题主要考查学生对粗盐提纯实验操作的熟练程度该题以溶液配制为载体,考查了仪器的名称与用途、操作的步骤、错误或不规范操作引起的溶质质量变化、量筒的读数、溶质质量分数的计算等问题,解答时要看清图示,结合具体知识点进行解答,有助于学生综合能力的提高.且在本题中又强调了细节的重要性,细节决定成败.

 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验: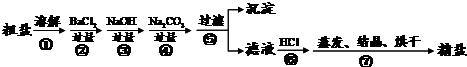
 ×100%=18%,故答案为:18%
×100%=18%,故答案为:18%

 ABC考王全优卷系列答案
ABC考王全优卷系列答案