
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加足量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
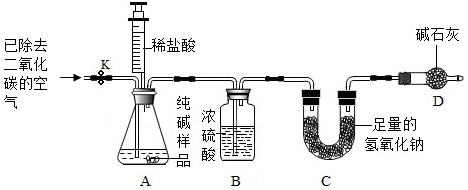
分析 (1)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(2)分析滴加的CaCl2溶液要足量的原因是能使碳酸钠完全反应;
(3)如果不洗涤沉淀物,沉淀物上会附着杂质;
(4)装置中的空气中含有二氧化碳;
(5)反应生成的二氧化碳被吸收的越充分,计算结果越准确;
D装置中的碱石灰能够防止空气中的二氧化碳进入C中;
(6)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)实验过程如下表所示:
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加足量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:初中化学 来源: 题型:选择题
| A. | 银、铜、铁的金属活动性强弱: | B. | 硫及其化合物与化合价的关系  | ||
| C. | 根据铁的含碳量将其分成生铁和钢  | D. | 物质形成溶液的pH: |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 某化工单位为了解仓库中久置的NaOH的纯度,先称取9.3g 的NaOH样品(杂质为Na2CO3)配成溶液,然后向溶液中逐滴加入稀盐酸,产生二氧化碳的质量与加入盐酸的质量的关系如图所示:
某化工单位为了解仓库中久置的NaOH的纯度,先称取9.3g 的NaOH样品(杂质为Na2CO3)配成溶液,然后向溶液中逐滴加入稀盐酸,产生二氧化碳的质量与加入盐酸的质量的关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 20克 | B. | 5克 | C. | 19克 | D. | 40克 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 盐酸 体积:500mL 化学式:HCl 相对分子质量:36.5 密度:1.2g/cm3 质量分数:37% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定含有炭粉,一定不含CaCO3 | |
| B. | 一定含有炭粉和Fe2O3 | |
| C. | 一定含有CaCO3,一定不含炭粉 | |
| D. | 一定含有炭粉和CaCO3,一定不含Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com