
【题目】实验室有一瓶含有硫酸的废液,老师请小红同学设计方案测定该废液中硫酸的溶质质量分数.小红同学先取一洁净小烧杯,称其质量为16.2g,然后往其中倒入少量硫酸废液后称量,总质量为56.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去掉铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为66.8g.
请回答下列问题:
(1)写出上述反应的化学方程式: .
(2)反应中产生的气体的质量是 g.
(3)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数).
(4)如果铁钉的铁锈未除净,对计算结果的影响是(选填“偏大”、“偏小”、“无影响”),原因是 .
【答案】
(1)Fe+H2SO4=FeSO4+H2↑
(2)0.2
(3)
设与铁反应的硫酸的质量为x,
烧杯中稀硫酸废液的质量为:56.2g﹣16.2g=40g
Fe+H2SO4═FeSO4+H2↑
98 2
x 0.2g
![]()
x=9.8g
该废液中硫酸的质量分数= ![]() 100%=24.5%.
100%=24.5%.
(4)偏小;硫酸与铁锈反应
【解析】(1)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式是:Fe+H2SO4=FeSO4+H2↑;(2)完全反应后,容器中的物质的质量差,就是生成氢气的质量,氢气的质量为:56.2g+10.8g﹣66.8g=0.2g;(4)由于硫酸与铁锈的反应,如果铁钉的铁锈未除净,对计算结果的影响是偏小.
本题主要考查有关化学方程式的计算,难度较小.根据质量的变化求出生成氢气的质量是进行有关计算的基础.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】用100 g KClO3和MnO2的混合物制取氧气,反应前测得MnO2 占混合物总质量的25%,反应一段时间后,又测得MnO2占30%。求:此时分解的KClO3的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图实验装置进行的相应实验,达不到实验目的是( ) 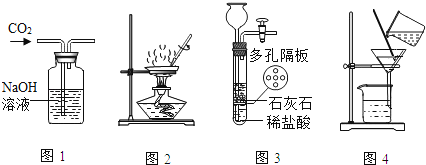
A.用图1所示装置除去CO2中含有的少量HCl气体
B.用图2所示装置加热蒸发NaCl饱和溶液得到NaCl晶体
C.用图3所示装置制取少量CO2气体
D.在实验室中,用图4所示装置除去河水中的少量泥沙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予发明和研究绿色荧光蛋白的三位科学家。绿色荧光蛋白分子中含有氨基(—NH2 , 具有碱的性质)和羧基(—COOH,具有酸的性质)。绿色荧光蛋白具有的性质是( )
A.既能与盐酸反应,又能与氢氧化钠反应
B.只能与氢氧化钠反应,不能与盐酸反应
C.只能与盐酸反应,不能与氢氧化钠反应
D.既不能与盐酸反应,又不能与氢氧化钠反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“节能减排,低碳生活”的主题旨在倡导节约能源和利用清洁能源,减少温室气体二氧化碳的排放。下列措施中不符合该主题的是( )
A.减少使用一次性塑料餐具
B.直接在田间焚烧秸秆,补充土壤中的钾元素
C.利用地沟油生产生物柴油
D.加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com