


| 实验序号 | 实验目的 | 实验方案 | 实验现象 | 结论 |
| 实验1 | ______ | 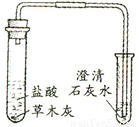 | ______ | 草木灰的主要成分是碳酸钾 |


科目:初中化学 来源: 题型:阅读理解
| 实验内容 | 实验现象 | 解释与结论 |
| 取少量溶液于试管中, | 证明研究结论正确 |
| 实验内容 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴酚酞试液 | 无色酚酞变红 | 无色溶液中有氢氧化钠 |
| 实验步骤 | 实验现象 | 实验结论 |
| 无色溶液中确实含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
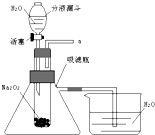 在化学晚会上,老师表演了“滴水生火”的魔术.他向包裹有过氧化钠粉末的脱脂棉上滴了几滴水,脱脂棉就燃烧起来了.
在化学晚会上,老师表演了“滴水生火”的魔术.他向包裹有过氧化钠粉末的脱脂棉上滴了几滴水,脱脂棉就燃烧起来了.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验内容 | 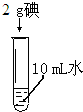 |
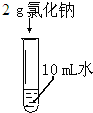 |
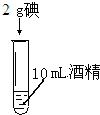 |
| 实验现象 | 碘几乎不溶于水,溶液呈淡黄色 | 氯化钠完全溶解,溶液透明无色. | 碘完全溶解在酒精中 |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验内容 | 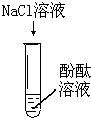 |
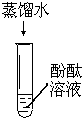 |
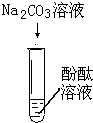 |
| 实验现象 | 无明显现象 | 无明显现象 | 溶液变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | 木条不复燃 | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气,因此木条不能复燃. |
| 实验二 | 在装有H2O2溶液的试管中加入少量的Fe2O3,然后将带火星的木条伸入试管中 | 木条复燃 | 加入能加快过氧化氢溶液分解的速率,所以可作过氧化氢溶液分解反应的催化剂. 加入能加快过氧化氢溶液分解的速率,所以可作过氧化氢溶液分解反应的催化剂. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com