
【题目】为减少温室气体排放,人们积极寻找不含碳元素的燃料。经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景,其反应的微观示意图为:

(1)NH3中N与H的元素质量比为 ;
(2)该反应的化学方程式为 ;
(3)从微观示意图可获得的信息是 。
科目:初中化学 来源: 题型:
【题目】石灰石是常用的建筑材料。
①甲乙同学设计了如下实验方案进行探究:
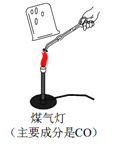
Ⅰ.甲同学取石灰石按图所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,由此甲同学认为石灰石已分解。甲同学结论不合理的理由是 。
写出石灰水变浑浊的化学方程式 。
Ⅱ.乙同学进行如下实验,完成下表
实验步骤 | 实验现象 | 实验结论 |
取少量煅烧后固体于试管中,加水振荡,过滤,取滤液,滴加 溶液 | 溶液变红 | 证明固体中 含有 |
取滤渣滴加足量的稀盐酸 | 含有碳酸钙 |
②为了测定石灰石中碳酸钙的质量分数(假设杂质不参加反应),乙同学设计称取石灰石样品100g,高温煅烧至质量不再改变。实验中固体的质量变化如下:

Ⅰ.生成二氧化碳的质量是 g。
Ⅱ.求石灰石中碳酸钙的质量分数。(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
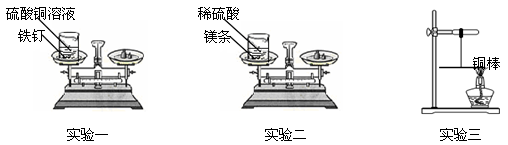
【设计并实验】
实验一:将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验二:将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验一和实验二的数据见下表:
编 号 | 实验一 | 实验二 |
反应前/g | 118.4 | 112.6 |
反应后/g | 118.4 | 112.4 |
实验三:用细线系住铜棒中点使之平衡,然后在铜棒一端用酒精灯加热。加热一段时间后,观察到铜棒的平衡情况是 。
【分析与讨论】
(1)在这三个实验中,你认为:实验 正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是 。
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是 (只写其中一个实验的原因即可)。
【实验反思】小组成员从不能正确反映反应物和生成物之间质量关系的两个实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在 中进行。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某同学设计的验证二氧化碳性质的实验装置图。请回答下列问题。
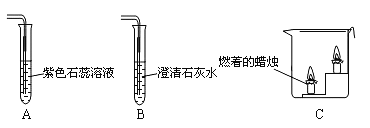
(1)将二氧化碳通入到A装置中,观察到的现象是 ;
(2)利用二氧化碳与B装置中的澄清石灰水反应,在实验室中可用于 ;
(3)将二氧化碳沿C装置烧杯左侧内壁缓慢倒入,通过观察到的实验现象,可说明二氧化碳具有 的性质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明对铁的锈蚀进行如下探究。室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧瓶塞.装置如图5 , 观察到量筒内水沿导管慢慢进入净容积为146 mL的广口瓶。当温度恢复至室温,且量筒内水面高度不再变化时读数。记录量筒起始和最终的读数以及所需时间如下表。


(1)实验①和②说明NaCl可以 (填“加快”或“减慢”)铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是 (填“放热”或“吸热”)过程。
(3)实验后滤纸包中生成的新物质主要成分的化学式: 。
(4)实验①和③是探究碳对铁锈蚀速率的影响,填写实验③的样品组成: 。
(5)小明认为该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是 (得数保留小数点后3位)。
(6)为进一步验证(5)小题的实验结果,现仅提供:量筒、大烧杯、玻璃棒、水、滤纸包(内含铁粉、碳、水和NaCl),请你帮助小明再设计一个测量空气中氧气体积含量的实验方案(可画简图表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】古代“银针验毒”的原理是:4Ag+2H2S+O2═2X+2H2O,X的化学式为
A. AgS B. Ag2O C. Ag2S D. Ag2O2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某钙片的标签如下,且知钙片成分中只有碳酸钙中含有钙元素:

(1)请计算碳酸钙中钙元素的质量分数为 ;
(2)请通过计算推断此标签中的含钙量是 (填虚假或真实)的;
(3)某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,充分反应后再称取烧杯和剩余物质的总质量,数据如下:
物质的质量 | |
反应前:烧杯+盐酸 | 22g |
10片钙片 | 8g |
反应后:烧杯+剩余物 | 26.7g |
请计算此钙片中碳酸钙的质量分数。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com