
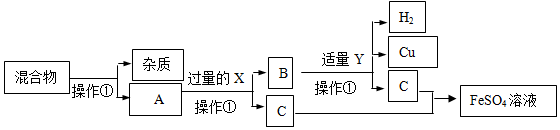
分析 根据题意:“欲从含有不溶性杂质的硫酸亚铁和硫酸铜的混合溶液中回收铜,并要获得硫酸亚铁溶液”,结合图框,推测:A中所含溶质的化学式:FeSO4、CuSO4,加入过量的铁粉,则B中所含物质的名称为:铁、铜.结合题给条件及图框信息可知:加入金属X得到了铜,可以判断金属X为铁,加入溶液Y后得到了铜,可以判断加入的Y为稀硫酸.
解答 解:根据题意:“欲从含有不溶性杂质的硫酸亚铁和硫酸铜的混合溶液中回收铜,并要获得硫酸亚铁溶液”,结合图框,推测:A中所含溶质的化学式:FeSO4、CuSO4,加入过量的铁粉,则B中所含物质的名称为:铁、铜.从图框中可以知道,向废液中加入过量的金属X得到了不纯的铜,根据题干要求及废水中的成分并结合最后得到对物质为硫酸亚铁晶体,可以判断金属X为铁;加入溶液Y后将过量的铁和铜分离得到了铜,可以判断加入的Y为稀硫酸;
(1)操作①为分离固体不溶物质的操作,故填:过滤.
(2)A中所含溶质为硫酸亚铁和硫酸铜,其化学式为:FeSO4、CuSO4;B中所含物质为过量的铁和反应生成的铜,属于混合物,故填:FeSO4、CuSO4;混合物.
(3)X过量的目的是把硫酸铜中的铜全部置换出来或使硫酸铜完全反应,则铁和硫酸铜溶液发生的化学方程式为:Fe+CuSO4═FeSO4+Cu,故填:把硫酸铜中的铜全部置换出来或使硫酸铜反应完全;Fe+CuSO4═FeSO4+Cu.
(4)铁和稀硫酸发生的化学方程式为:Fe+H2SO4═FeSO4+H2↑,该反应属于置换反应,故填:Fe+H2SO4═FeSO4+H2↑;置换反应.
(5)硫酸亚铁的水溶液为浅绿色,故填:浅绿色.
点评 想解答好这类题目,首先,要理解和运用酸的化学性质、用途、反应现象和化学方程式,以及与之相关的知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | A | B | C | D | E |
| 反应前的质量(g) | 50 | 4 | 4.6 | 1 | 5 |
| 反应后的质量(g) | 待测 | 20 | 23 | 4.2 | 5 |
| A. | 待测的值为12.4 | B. | C与D在反应中的质量比为23:4.2 | ||
| C. | 该反应属于化合反应 | D. | E一定是该反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ca(OH)2+CO2=CaCO3↓+H2O | B. | 2H2O═2H2↑+O2↑ | ||
| C. | 3CO+Fe2O3═2Fe+3CO2 | D. | HCl+AgNO3═AgCl↓+HNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com