
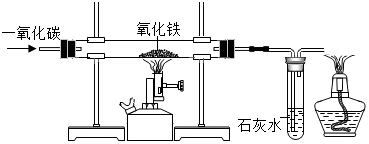
分析 (1)根据硬质玻璃管内中一氧化碳还原氧化铁生成铁和二氧化碳来分析;
(2)根据一氧化碳易可燃,容易发生爆炸考虑;
(3)由于一氧化碳有毒,如果直接排放到空气中,会造成污染;可用点燃的方法将一氧化碳燃烧掉,防止污染空气.
解答 解:(1)红色的氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,所以玻璃管中出现的现象是红色固体变为黑色,其化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;故填:红色固体变为黑色;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)因为一氧化碳具有可燃性,能和氧气混合在点燃的条件下会发生爆炸,所以实验开始时应先通一氧化碳再加热,目的是赶尽玻璃管内的空气,防止加热爆炸;故填:赶尽玻璃管内的空气,防止加热时爆炸;
(3)由于一氧化碳有毒,如果直接排放到空气中,会造成污染,可用点燃的方法将一氧化碳燃烧掉,防止污染空气;故填:除去多余的CO,防止污染空气.
点评 本题主要考查一氧化碳与氧化铁反应实验装置、实验现象、一氧化碳的毒性,难度稍大.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳、铝、铜 | B. | 碳、铜、锌 | C. | 铜、镁、锌 | D. | 铝、铜、锌 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加入适量纯碱 | B. | 加热 | C. | 加入适量食醋 | D. | 加入适量明矾 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 任意排放工业污水 | B. | 禁止使用农药和化肥 | ||
| C. | 生活污水经净化处理后再排放 | D. | 抑制水中所有植物生长 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生铁和钢的性能不同--含碳量不同 | |
| B. | 氮和氧的元素种类不同--核内质子数不同 | |
| C. | 一氧化碳和二氧化碳的化学性质不同--氧原子个数不同 | |
| D. | 带火星的木条在空气和氧气中的现象不同--氧气浓度不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碘、硒等微量元素对人体健康只有微小作用 | |
| B. | 使用化肥和农药是作物增产的重要途径 | |
| C. | 医疗上硫酸钡可用作钡餐透视 | |
| D. | 氯化钠可用作调味品和防腐剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
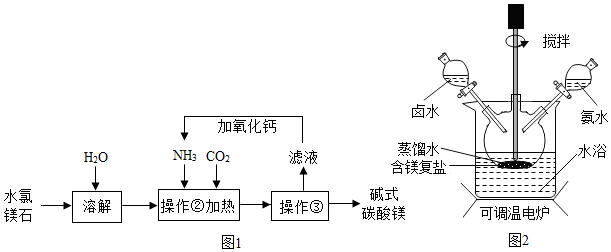
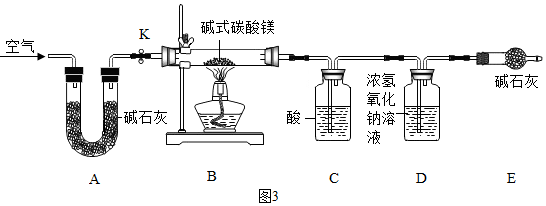
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com