
 2H2↑+O2↑ 红 CO2+H2O═H2CO3 10 40 量筒、滴管、烧杯、玻璃棒
2H2↑+O2↑ 红 CO2+H2O═H2CO3 10 40 量筒、滴管、烧杯、玻璃棒 ×100%计算即可;根据配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.选择仪器即可.
×100%计算即可;根据配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.选择仪器即可. 2H2↑+O2↑.
2H2↑+O2↑. ×100%,所以:20%=
×100%,所以:20%=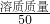 ×100%,溶质质量是10g,加水40mL.
×100%,溶质质量是10g,加水40mL.

科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?宝山区一模)水是宝贵的自然资源,在工农业生产和日常生活中有广泛的应用.
(2012?宝山区一模)水是宝贵的自然资源,在工农业生产和日常生活中有广泛的应用.
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 污染源 | 防止污染的建议 | |
| 生活中 | 例如:含磷洗涤剂 (1) 生活污水 生活污水 ; |
少用或不用 (1) 处理后再排放 处理后再排放 |
| 生产中 | (2) 工业生产中的“三废“ 工业生产中的“三废“ ;(3) 滥用农药、化肥 滥用农药、化肥 ; |
(2) 先治污,达标后排放 先治污,达标后排放 .(3) 农药、化肥合理使用 农药、化肥合理使用 . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com