
分析 (1)利用质量守恒定律,可由反应前后质量差求出放出二氧化碳的质量;
(2)根据反应的化学方程式,计算参加反应碳酸钙质量,从而求得石灰石中CaCO3的质量分数.
解答 解:(1)生成二氧化碳的质量为:25g+100g-116.2g=8.8g;
(2)设参加反应的碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 8.8g
$\frac{100}{x}=\frac{44}{8.8g}$
x=20g
石灰石中CaCO3的质量分数=$\frac{20g}{25g}$×100%=80%;
答:(1)生成二氧化碳的质量为8.8g;
(2)石灰石中CaCO3的质量分数为80%.
点评 根据质量守恒定律分析得反应放出二氧化碳的质量,此为解答本题的计算基础,体现出对问题的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 根据木炭、细铁丝在氧气中燃烧的实验图片回忆,按要求回答问题.
根据木炭、细铁丝在氧气中燃烧的实验图片回忆,按要求回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
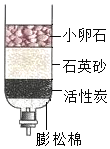 化学与生活息息相关.
化学与生活息息相关.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
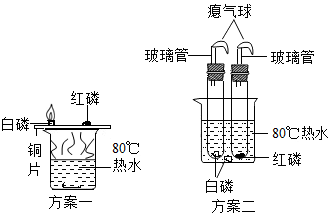 某化学小组想研究燃烧的条件,设计了如图二个实验方案,下列关于方案设计说法不合理的是( )
某化学小组想研究燃烧的条件,设计了如图二个实验方案,下列关于方案设计说法不合理的是( )| A. | 方案一想通过铜片上白磷和红磷的现象对比,说明可燃物燃烧必须达到一定温度 | |
| B. | 方案二想通过试管中白磷和水中白磷的现象对比,说明可燃物燃烧必须达到一定温度 | |
| C. | 方案二比方案一的设计更环保 | |
| D. | 方案二的两个试管应装有氧气或空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
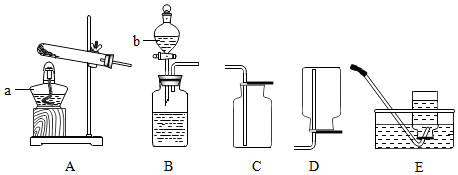
| 必须遵循操作先后的实验 | 先进行的操作 | 后进行的操作 |
| a制取氧气 | 检查装置气密性 | 再向容器中装药品 |
| b氯酸钾制取氧气用排水发收集氧气结束时 | 先将导管从水槽移开 | 熄灭酒精灯 |
| 给药品加热 | 先均匀受热 | 再集中加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com