
科目:初中化学 来源: 题型:阅读理解


| ||
| ||
| ||
| ||
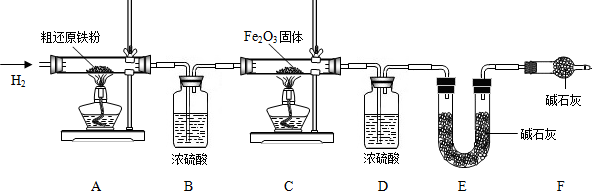
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
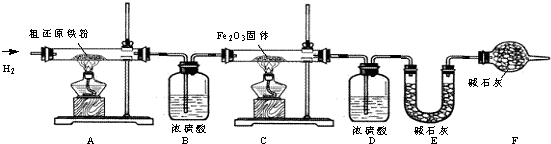
查看答案和解析>>
科目:初中化学 来源:轻巧夺冠人教版九年级化学下 题型:058
某实验活动小组试验一氧化碳的性质,并测定铁的氧化物中铁和氧的质量比.所用实验装置如下图所示:
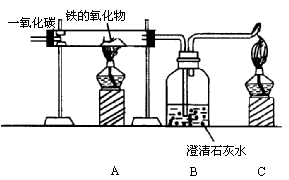
请回答下列问题:
(1)若用加热某固体的方法制取一氧化碳气体的发生装置中,可能用到的仪器有:a.试管b.烧杯c.蒸发皿d.酒精灯e.铁架台(带铁夹)f.带导管的橡皮塞.请用编号填写发生装置中所需要的仪器是_________.
(2)有下列实验步骤:①给铁的氧化物加热;②通入一氧化碳气体;③停止给铁的氧化物加热;④停止通一氧化碳.正确的操作步骤为________.(填写编号)
(3)装置B中发生反应的化学方程式是________________.
(4)若已知铁的氧化物为Fe2O3,则装置A中发生反应的化学方程式是________________________________.
(5)由上述实验可知,一氧化碳具有________性.
(6)在C处放置燃着的酒精灯,目的是________________________________.
(7)若已知铁的氧化物的质量为0.36g,与一氧化碳完全反应后,B装置增重0.22g,则参加反应的一氧化碳的质量是________.
(8)此铁的氧化物中铁与氧的质量比是________________.
查看答案和解析>>
科目:初中化学 来源:1+1轻巧夺冠·同步讲解 化学 九年级下册 人教版 金版 人教版 题型:058
某实验活动小组试验一氧化碳的性质,并测定铁的氧化物中铁和氧的质量比.所用实验装置如下图所示:

请回答下列问题:
(1)若用加热某固体的方法制取一氧化碳气体的发生装置中,可能用到的仪器有:a.试管b.烧杯c.蒸发皿d.酒精灯e.铁架台(带铁夹)f.带导管的橡皮塞.请用编号填写发生装置中所需要的仪器是________.
(2)有下列实验步骤:①给铁的氧化物加热;②通入一氧化碳气体;③停止给铁的氧化物加热;④停止通一氧化碳.正确的操作步骤为________.(填写编号)
(3)装置B中发生反应的化学方程式是________.
(4)若已知铁的氧化物为Fe2O3,则装置A中发生反应的化学方程式是________.
(5)由上述实验可知,一氧化碳具有________性.
(6)在C处放置燃着的酒精灯,目的是________.
(7)若已知铁的氧化物的质量为0.36 g,与一氧化碳完全反应后,B装置增重0.22 g,则参加反应的一氧化碳的质量是________.
(8)此铁的氧化物中铁与氧的质量比是________.
查看答案和解析>>
科目:初中化学 来源:江苏省模拟题 题型:实验题
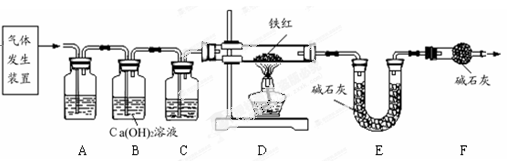

 x Fe + y H2O,Fe3C + 2H2
x Fe + y H2O,Fe3C + 2H2 3 Fe + CH4。
3 Fe + CH4。
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com