
| 物质 | NaHCO3 | NH4Cl |
| 溶解度/g(20℃) | 9.6 | 37.2 |
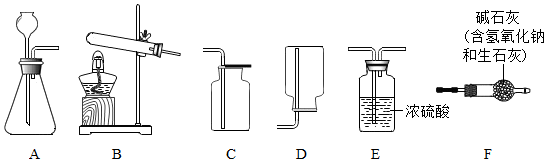
分析 (1)石灰石中的碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳能够溶于水,密度比空气大;
(2)根据反应物的性质可以选择发生装置;
氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气;
(3)相同条件下,物质的溶解度越小,越容易从溶液中析出;
(4)NH4Cl在农业生产中常被用作氮肥.
解答 解:(1)实验室常采用石灰石与稀盐酸反应制备CO2,石灰石中的碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
因为二氧化碳密度比空气大,可以用向上排空气法收集,即可以用C装置收集.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;C.
(2)实验室利用氢氧化钙和氯化铵制取氨气时需要加热,应该用B装置作为发生装置;
因为碱石灰中的氧化钙和氢氧化钠都不能和氨气反应,并且能够吸收水蒸气,因此可以用F装置对氨气进行干燥;
实验室制备O2用上述制备NH3的发生装置时,应该是利用氯酸钾和二氧化锰制取,氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
故填:B;F;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)20℃产物中NaHCO3能够先从溶液中结晶析出的原因是20℃时碳酸氢钠的溶解度小于氯化铵的溶解度.
故填:20℃时碳酸氢钠的溶解度小于氯化铵的溶解度.
(4)该过程中另一产物NH4Cl在农业生产中常被用作氮肥.
故填:氮肥.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.30g | B. | 0.20g | C. | 0.15g | D. | 0.45g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4:13 | B. | 3:10 | C. | 2:7 | D. | 1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.
如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ag | B. | Ag 和 Zn | C. | Cu 和 Ag | D. | Cu、Zn 和 Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com