
| 实验步骤 | 实验现象 | 实验结论 | |
| 甲同学 | 取1支试管,加入少量黄色液体,然后滴加高锰酸钾溶液,再滴加KSCN溶液 | 高锰酸钾溶液褪色,溶液变为血红色 | 黄色溶液中有HCl、FeCl2和FeCl3 |
| 乙同学 | 取2支试管,分别加入少量黄色溶液.再向试管①中滴加KSCN溶液;向试管②中加入铁粉,再滴加高锰酸钾溶液 | 试管①中溶液变为血红色;试管②中产生大量气泡,高锰酸钾溶液褪色 | 黄色溶液中有HCl、FeCl2和FeCl3 |
| 丙同学 | 取3支试管,分别加入少量黄色溶液.再向试管①中滴加KSCN溶液;试管②中加入铁粉;试管③中滴加高锰酸钾溶液 | 试管①中溶液变为血红色;试管②…;试管③中高锰酸钾溶液褪色 | 黄色溶液中有HCl、FeCl2和FeCl3 |
分析 (1)根据氧化铁与稀盐酸反应生成氯化铁和水,写出反应的化学方程式解答;
(2)根据题中信息和实验结论分析解答;
(3)在酸性条件下,FeCl2可以使高锰酸钾溶液褪色,并生成FeCl3解答;
(4)根据混合物中相互之间不反应解答;
(5)根据在混合体系中检验多种物质存在时,要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等解答.
解答 解:
(1)氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
(2)取3支试管,分别加入少量黄色溶液.再向试管①中滴加KSCN溶液;试管②中加入铁粉;试管③中滴加高锰酸钾溶液,试管①中溶液变为血红色,说明黄色溶液中有FeCl3,试管②种溶液中产生大量气泡,说明黄色溶液中有HCl,试管③中高锰酸钾溶液褪色,说明黄色溶液中有FeCl2;
(3)三位同学的方案不合理的是甲和乙;
甲中取1支试管,加入少量黄色液体,然后滴加高锰酸钾溶液,再滴加KSCN溶液,高锰酸钾溶液褪色,溶液变为血红色,不能说明黄色溶液中有FeCl3
,因为依据资料②,FeCl2和高锰酸钾反应时生成了FeCl3,无法证明黄色溶液中有FeCl3;
乙中依据资料①,加入Fe粉时,Fe与盐酸或FeCl3反应生成了FeCl2,无法证明黄色溶液中有FeCl2
(4)混合物中相互之间不反应,各种成分能保持各自的化学性质.
(5)在混合体系中检验多种物质存在时,要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等.
答案:
(1)Fe2O3+6HCl═2FeCl3+3H2O;
(2)产生大量气泡;
(3)故答案为:甲和乙
甲:依据资料②,FeCl2和高锰酸钾反应时生成了FeCl3,无法证明黄色溶液中有FeCl3
乙:依据资料①,加入Fe粉时,Fe与盐酸或FeCl3反应生成了FeCl2,无法证明黄色溶液中有FeCl2
(4)能;
(5)要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等(合理即得分).
点评 本题考查学生铁以及化合物的性质、亚铁离子和三价铁离子的检验知识,属于综合知识的考查,难度不大.


科目:初中化学 来源: 题型:解答题
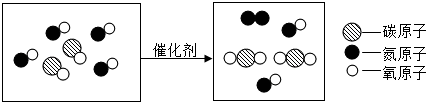
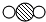 中“
中“ ”与“
”与“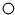 ”的质量比是3:8(填最简整数比).
”的质量比是3:8(填最简整数比).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
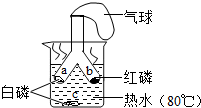 如图所示为探究燃烧条件的实验方案.将白磷和红磷分装于Y形管的两支管中,管口牢系小气球,将两支管同时深入热水中.
如图所示为探究燃烧条件的实验方案.将白磷和红磷分装于Y形管的两支管中,管口牢系小气球,将两支管同时深入热水中.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 | 溶液变红色 | 猜想(3)成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com