
 将某氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,直至过量.根据实验事实绘制如图所示曲线,其中说法正确的是( )
将某氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,直至过量.根据实验事实绘制如图所示曲线,其中说法正确的是( )| A. | a至b段有蓝色沉淀生成 | B. | a至d段氯化钠质量不断增大 | ||
| C. | c点比a点所含的溶质种类少 | D. | c至d段,溶液pH不断减小 |
分析 向一定量盐酸和氯化铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程在氢氧化钠先和盐酸反应,然后和氯化铜反应,据此分析.
解答 解:向一定量盐酸和氯化铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程在氢氧化钠先和盐酸反应,然后和氯化铜反应.
A、a至b段是氢氧化钠中和盐酸,没有蓝色沉淀生成,故说法错误;
B、a至c段氯化钠的质量逐渐增大,c到d端氯化钠质量不再增加,故说法错误;
C、c点时氯化铜恰好完全反应,此时对应溶液中的溶质只有氯化钠,溶质种类最少,故说法正确;
D、c至d段,溶液pH不断减小,氢氧化钠过量,溶液中氢氧化钠增多,碱性变大,pH变大,故说法错误;
故选:C.
点评 解答本题的关键是要理解图象的物理意义和所代表的反应的反应原理和相关物质的定量反应关系,难度不大.


科目:初中化学 来源: 题型:解答题
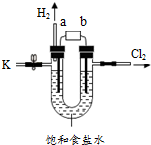 某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.| 加入稀硫酸的质量/g | 0 | 4.0 | 6.0 | 8.0 | 10.0 | 12.0 |
| 烧杯中溶液的pH | 13.0 | 12.8 | 12.5 | 12.3 | 7.0 | 1.3 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | 由不同种元素组成的物质一定是化合物 | |
| C. | 盐的组成元素中一定不含氢元素 | |
| D. | 不饱和溶液变成饱和溶液后溶质的质量分数可能不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作步骤 | 实验现象 | 结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. | 实验过程中有气泡产生. | 则证明猜想Ⅰ成立 |
| 步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液. | 实验过程中产生 白色沉淀. | 则证明猜想Ⅱ或Ⅲ成立.此过程中发生反应的化学方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl. |
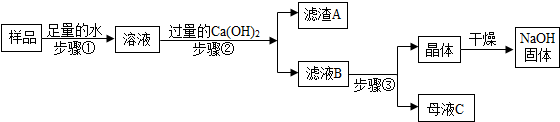
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸溶于水能放出热量 | B. | 浓硫酸具有挥发性 | ||
| C. | 浓硫酸具有腐蚀性 | D. | 浓硫酸具有吸水性 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将亚硝酸盐当食盐食用 | |
| B. | 电器失火时,先用水灭火 | |
| C. | 不接触高于安全电压的低压带电体,不靠近高压带电体 | |
| D. | 有金属外壳的家用电器,其外壳的接地线要接在电源的零线上 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com