
“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【实验探究一】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,催化效果如何?
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
| 实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
(1)氧化铁能加快过氧化氢分解的反应速率
(2)化学性质 质量
(3)H2O2  H2O + O2
H2O + O2
(4)二氧化锰催化效果比氧化铁好
(5)反应物浓度(或浓度)③和④温度越高,化学反应速率越快
(6)反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快
解析试题分析:(1)通过对比实验,说明氧化铁确实改变了过氧化氢分解的速率。
(2)实验Ⅱ说明氧化铁仍能对过氧化氢的分解起加快作用,说明其化学性质没有发生改变。实验Ⅲ通过两次称量,说明其质量在反应前后并没有发生改变。
(3)这个反应和二氧化锰作催化剂时的反应一样,只需将催化剂由二氧化锰转换成氧化铁即可。反应的化符号表达式为:H2O2 H2O + O2
H2O + O2
(4)由于D试管中用的是二氧化锰,若实验IV观察到D试管中产生气泡的速率更快,可以得到的结论是二氧化锰催化效果比氧化铁好。
(5)实验①和②中唯一的不同是过氧化氢溶液的浓度,所以我们可以得出反应速率还与反应物的浓度有关。要得出化学反应速率与温度的关系,只需找到温度不同而其他条件完全相同的两个实验作对比,观察表格,容易发现实验③和④符合我们的要求,且它们之间的关系是:温度越高,化学反应速率越快。
(6)根据题目信息“化学反应的实质是微观粒子相互接触、碰撞的结果”,不难理解得出:反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快。
考点:催化剂概念的理解,化学反应速率影响因素的探究


科目:初中化学 来源: 题型:探究题
实验室里,试剂瓶的标签常因脱落或被腐蚀而丢失,现有失去标签的6瓶溶液,可能是NaCl、Na2CO3、NaOH、CaCl2、Ca(OH)2、HCl、CuSO4七种物质中的六种,教师将它们编号为A、B、C、D、E、F,让同学们鉴别这六种物质,请你参与小明的下列鉴别过程.
[查阅资料]:CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
(1)观察各种溶液的颜色,其中C瓶为 色,是硫酸铜溶液.
(2)做两两混合实验,E与其他四种物质混合的实验现象记录如下:
| | A | B | D | F |
| E | 无现象 | 白色沉淀 | 无色气泡 | 白色沉淀 |
| 实验操作 | 实验现象及实验结论 |
| | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小红为大家做了一个“燃纸成铁”的趣味实验。将一张滤纸(组成元素为C、H、O)用FeCl3 浓溶液润湿,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质。小红告诉大家:黑褐色物质中含有铁单质。
【提出问题】黑褐色物质中真的含有铁单质吗?
【探究过程】
(1)小红先从反应物组成分析,因为 所以反应后可能生成铁单质。
(2)为获得实验证据,小红做了实验1。
实验1:将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生。若黑褐色物质中
含有铁单质,则反应的化学方程式为 。
(3)小明提出疑问:实验1中产生的气泡也可能是滤纸碳化后吸附的空气。为此,小红又做了实验2: 观察到有微小气泡产生但很快停止。
证明实验1中的连续气泡确实是由铁单质与稀盐酸反应产生的。
(4)为进一步证明黑褐色物质中有铁单质,小红又做了实验3。
实验3:将黑褐色物质放入 溶液中,观察到红色物质生成。
【得出结论】通过以上实验探究,证明黑褐色物质中确实含有铁单质。
(5)【实验反思】小红所做实验1和实验2是运用了 实验,使结论更有说服力。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
铁暴露在空气中会生锈。不知你注意了没有,将苹果切开不久,果肉上就会产生一层咖啡色的物质,也好象是生了“锈”一样。某化学活动小组对此进行了探究。
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
【收集证据】
(一)查阅有关资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生氧化反应,生成咖啡色的物质。且温度越高反应越快。
(二)实验探究:针对上面的猜想,化学活动小组依次设计了实验方案,将苹果肉分别放入 三种气体中,依次观察到下列实验现象。请你帮他们填写下表。
| | 氮气 | 氧气 | 二氧化碳 |
| 现象 | 不变色 | 变色 | |
| 结论 | 果肉变色与氮气无关 | | 果肉变色与二氧化碳无关 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学兴趣小组同学为了研究影响分子运动速率的因素,如下图所示,玻璃管左、右两端分别放有脱脂棉,注射器中分别装有浓盐酸和浓氨水。浓氨水挥发出来的氨气(NH3)和浓盐酸挥发出来的氯化氢(HCl)能发生如下反应,NH3+ HCl=NH4Cl。两个注射器同时向脱脂棉靠]近里边的部位注入等体积的液体,过一会,先在A处产生大量白烟,然后白烟逐渐充满整个试管。
根据现象回答问题:
(1)生成物NH4Cl常温下的状态是 (填“固体”、“液体”或“气体”);
(2)有同学认为先在A处产生白烟是因为HCl分子比NH3分子运动速度慢,请你分析影响分子运动速度的因素可能是 ;
(3)影响分子运动速率的因素还有温度,请举出生活中的一个实例 ;
(4)该实验中的注射器也可改用胶头滴管直接滴入液体,相比较用注射器的优点是 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学小组同学利用如图所示装置进行实验.
(1)若装置Ⅰ中加入石灰石和过量稀盐酸,装置Ⅱ中加入澄清石灰水.打开a,关闭b,装置Ⅰ中观察到的现象是 ;一段时间后,关闭a,打开b,装置Ⅱ中观察到的现象是 .
(2)若利用装置Ⅱ完成模拟合成氨气(N2+3H2 2NH3)过程中的气体混合实验.从装置Ⅱ右侧导管通入氮气,左侧导管通入氢气,则装置Ⅰ中加入的药品是 ,装置Ⅱ中加入浓硫酸,则装置Ⅱ的作用有:① ;②使氮气和氢气充分混合;③通过观察 来控制气体的体积比,从而提高氮气和氢气的利用率.
2NH3)过程中的气体混合实验.从装置Ⅱ右侧导管通入氮气,左侧导管通入氢气,则装置Ⅰ中加入的药品是 ,装置Ⅱ中加入浓硫酸,则装置Ⅱ的作用有:① ;②使氮气和氢气充分混合;③通过观察 来控制气体的体积比,从而提高氮气和氢气的利用率.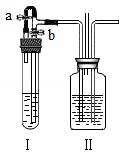
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
张丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她设计并完成了下表所示的探究实验:
| | 实验操作 | 实验现象 | 实验结论或总结 | |
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但反应速率 。 反应的化学方程式为: 。 | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | | |
| 实验三 | | | 二氧化锰能加快过氧化氢的分解 | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某研究性学习小组将实验室制备二氧化碳气体反应后的废物进行处理,目的是制取中性干燥剂CaCl2。得到固体后,他们对固体的成分进行了如下探究:
[提出猜想]
猜想一:只有CaCl2;
猜想二:CaCl2和CaCO3;
猜想三:CaCl2和HCl。
| | 操作 | 现象 | 结论 |
| 步骤一 |  | | 猜想二成立 |
| 步骤二 |  | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
几年前,一辆载满20t电石的挂车,在浙江滨江区燃起熊熊大火并伴有大量黑烟.事故路面上洒落了五六百米燃着的石头.这辆货车在雨中整整燃烧了一天,消防官兵对大火也束手无措,场面让人震撼.大家对电石的化学性质产生了浓厚的兴趣,请你一起与他们完成下列探究活动.
【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟.
【猜想与假设】
电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.大家做出以上推断的理由是 .
大家讨论后一致认为该气体不可能是氧气,原因是 ,白色固体不可能是氧化钙,原因是(用化学方程式表示) .
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取适量电石加水反应,收集生成的气体,验纯后点燃. | 气体燃烧,产生黄色火焰并伴有浓烈黑烟. | 电石与水反应产生的气体是 |
| (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. | 固体溶解, . | 电石与水反应产生的固体不是碳酸钙 |
| (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2~3滴 . | 溶液变红 | 电石与水反应产生的固体是氢氧化钙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com