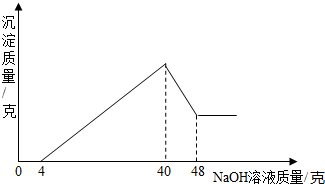
解:(1)Al
2O
3、Fe
2O
3与H
2SO
4反应生成 Al
2(SO
4)
3、Fe
2(SO
4)
3,从图分析,过滤掉SiO
2滤液有H
2SO
4、Al
2(SO
4)
3、Fe
2(SO
4)
3,
加入氢氧化钠全部反应需用NaOH溶液量为40克,转化为沉淀Fe(OH)
3、Al(OH)
3,硫酸与它们的反应转化为与NaOH反应.
设硫酸溶液的溶质是质量分数X
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98
40g×20% X×50g

=

X=19.6%
(2)从图分析,后来沉淀减少是由于Al(OH)
3+NaOH=NaAlO
2+2H
2O,用于该反应的NaOH
溶液8克.设生成的氢氧化铝的质量是Y
Al(OH)
3+NaOH=NaAlO
2+2H
2O
78 40
Y 8g×20%

Y=3.12克
根据化学方程式或化学反应前后原子个数不变
Al
2O
3~Al
2(SO
4)
3~2Al(OH)
3102 78×2
Z 3.12g

=
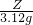
Z=2.04克
假设与硫酸铝反应的氢氧化钠质量是A
Al
2(SO
4)
3+6NaOH=2Al(OH)
3↓+3Na
2SO
4 240 156
A 3.12g
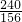
=

A=4.8g
Fe
2O
3~Fe
2(SO
4)
3~6NaOH
160 240
B (40-4)g×20%-4.8g=2.4g

=

B=1.6g
SiO
2:5-2.04-1.6=1.36克
答:(1)硫酸溶液的溶质质量分数为19.6%(2)铝土矿中含Al
2O
3、Fe
2O
3、SiO
2的质量分别是2.04g、1.6g、1.36g.
分析:(1)利用硫酸与Al
2O
3,Fe
2O
3反应后生成Al
2(SO
4)
3、Fe
2(SO
4)
3,再有它们与氢氧化钠反应生成沉淀,就转化成了硫酸与NaOH反应,对硫酸的溶质质量分数进行求解.
(2)利用化学方程式结合图象中的两个关键点:消耗40g氢氧化钠是沉淀的最大值;沉淀减少时主要的是发生的Al(OH)
3+NaOH=NaAlO
2+2H
2O,消耗氢氧化钠的质量是8g,再结合质量守恒定律及关系式法分析解决即可
点评:此题是一道计算的综合型题目,解题的关键是对图象的分析以及元素守恒的综合运用,按难度应该属于竞赛题性质的范畴.

 =
=

 =
=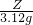
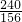 =
=
 =
=


 提分百分百检测卷系列答案
提分百分百检测卷系列答案