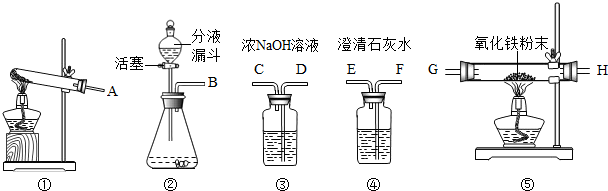
解:(1)铁架台常用的夹持仪器,故答案为:铁架台
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;实验室制取CO
2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;实验室是用锌粒和稀硫酸在常温下反应制氢气的,因此不需要加热;故答案为:B D; 2KMnO
4
K
2MnO
4+MnO
2+O
2↑;C E (或ABE); CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;C E (或ABE);Zn+2HCl=ZnCl
2+H
2↑
(3)一氧化碳还原氧化铁的实验中,发生的现象是:红色粉末逐渐变黑,澄清的石灰水变浑浊;二氧化碳一般用澄清的石灰水检验;该装置的不足之处是:c处缺少尾气处理装置;故答案为:红色粉末逐渐变黑;澄清的石灰水;CO
2+Ca(OH)
2=CaCO
3↓+H
2O;c处缺少尾气处理装置
(4)若用图二装置进行“排空气法”收集制取的H
2,因为氢气的密度比空气小,因此应该从短管进入;故答案为:(如右图)
(5)490g20%的稀硫酸中,硫酸的质量=490g×20%=98g
设废铁屑中铁的质量为x,制得硫酸亚铁的质量为y
Fe+H
2SO
4=FeSO
4+H
2↑
56 98 152
x 98g y
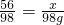
,x=56g 废铁屑中铁的质量分数=

×100%=70%
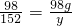
,y=152g
答:制得硫酸亚铁的质量为152g,废铁屑中铁的质量分数是70%
故答案为:152g;70%
分析:铁架台常用的夹持仪器,制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO
2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.一氧化碳还原氧化铁的实验中,发生的现象是:红色粉末逐渐变黑,澄清的石灰水变浑浊;二氧化碳一般用澄清的石灰水检验;该装置的不足之处是:c处缺少尾气处理装置.若用图二装置进行“排空气法”收集制取的H
2,因为氢气的密度比空气小,因此应该从短管进入.有关的计算要准确.
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 K2MnO4+MnO2+O2↑;C E (或ABE); CaCO3+2HCl=CaCl2+CO2↑+H2O;C E (或ABE);Zn+2HCl=ZnCl2+H2↑
K2MnO4+MnO2+O2↑;C E (或ABE); CaCO3+2HCl=CaCl2+CO2↑+H2O;C E (或ABE);Zn+2HCl=ZnCl2+H2↑
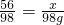 ,x=56g 废铁屑中铁的质量分数=
,x=56g 废铁屑中铁的质量分数= ×100%=70%
×100%=70%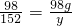 ,y=152g
,y=152g