(2012?塘沽区一模)金属材料在生产、生活中的应用非常广泛.

(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的
B
B
(填字母序号).
A.导电性 B.导热性 C.延展性
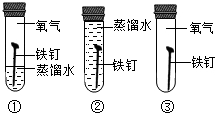
(2)金属锈蚀造成浪费.铁制品锈蚀的过程,实际上是铁与空气中的氧气、
水
水
等发生化学反应的过程.
(3)目前世界上已有50%以上的废钢铁得到回收利用,其目的是
A
A
.
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(4)实验室有锌片、铁片、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液和硫酸铜溶液7种物质,小红选择合适的物质,设计了以下三种方法对锌、铜、铁的金属活动性顺序进行验证.
①方法一所选用的3种物质是
铁片
铁片
、硫酸锌溶液和硫酸铜溶液.
②方法二所选用的3种物质是锌片、铜片和
硫酸亚铁溶液
硫酸亚铁溶液
.
③方法三所选用4种物质是锌片、铁片、铜片和稀硫酸,能验证锌、铁、铜的金属活动性顺序的实验现象是
铜与稀硫酸没有气泡生成,锌、铁均能与稀硫酸反应产生大量气泡,且锌的反应比铁剧烈
铜与稀硫酸没有气泡生成,锌、铁均能与稀硫酸反应产生大量气泡,且锌的反应比铁剧烈
.
(5)炼铁的原理是利用一氧化碳与氧化铁反应.在实验室里,可用如图1所示装置进行实验:实验中玻璃管内的粉末由红色变为
黑
黑
色,该反应的化学方程式为
.某钢铁厂每天需消耗5 000t含Fe
2O
396%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁
3428.6
3428.6
t.(计算结果保留1位小数)
(6)向CuSO
4溶液中加入Zn、Fe、Mg混合物,充分搅拌后过滤,得浅绿色溶液A,将滤渣放入稀盐酸中,产生无色气体.由以上事实可推知滤液A中含有的溶质是
MgSO4 ZnSO4 FeSO4
MgSO4 ZnSO4 FeSO4
,滤渣B中含有的物质是
Fe Cu
Fe Cu
.
(7)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图2、3所示.下列相关判断中,正确的是
AC
AC
.
A.甲是铁,乙是锌 B.甲是锌,乙是铁
C.图2表示稀硫酸足量,图3表示稀硫酸不足量
D.图2表示金属一定有剩余,图3表示金属一定没有剩余.


 金属材料在生产、生活中的应用非常广泛.
金属材料在生产、生活中的应用非常广泛.