
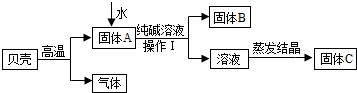
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀盐酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液碳酸钠溶液 | 生成白色沉淀 | 猜想成立 |
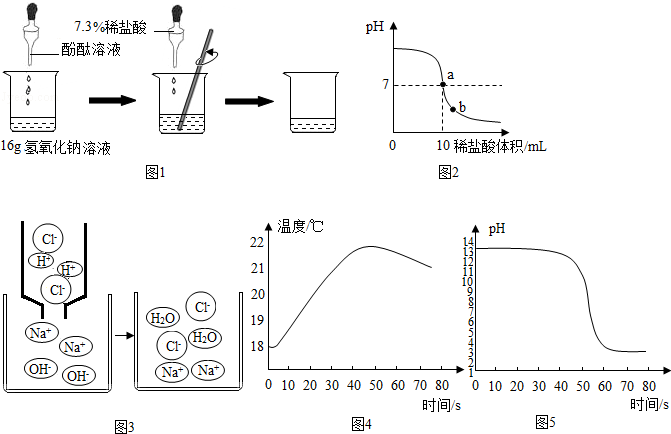
分析 (1)煅烧碳酸钙时,碳酸钙分解能生成氧化钙和二氧化碳;
(2)过滤时要用到的主要仪器之一是漏斗;
(3)玻璃棒的用途有搅拌、引流、转移物质等;
[猜想与假设]根据反应生成的产物作出猜想;
[探究与验证]显碱性的溶液能使酚酞试液变红色,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
【反思与评价】
碳酸钠、氢氧化钙的水溶液都显碱性,都能够使酚酞试液变红色.
解答 解:(1)贝壳高温煅烧时,含有的碳酸钙受热分解生成氧化钙和二氧化碳,反应的化学方程式是:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)操作I中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是:使液体受热均匀,防止液滴外溅.
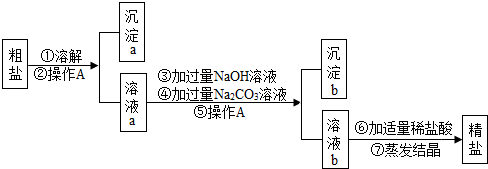
[猜想与假设]氧化钙和水反应生成了氢氧化钙,而氢氧化钙可以和碳酸钠反应生成氢氧化钠,若氢氧化钙是过量的,则在反应后的溶液中还含有氢氧化钙,即丙可以作出固体C为氢氧化钠和氢氧化钙的猜想;
[探究与验证]乙:取少量固体C,溶于适量水形成溶液后,滴加足量的稀盐酸,如果无气泡产生,说明氢氧化钠中不含有碳酸钠,猜想不成立.
丙:取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液,如果出现白色沉淀,说明氢氧化钠中含有氢氧化钙,猜想成立.
【反思与评价】根据实验流程,可以判定甲同学设计的方案不严密,理由是:因为碳酸钠、氢氧化钙的水溶液都显碱性,无论碳酸钠过量还是氢氧化钙过量,混有碳酸钠或氢氧化钙的氢氧化钠配成溶液后,都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠,故甲同学设计的方案是错误的;
故答案为:(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)漏斗;
(3)使溶液体受热均匀,防止液滴外溅;
[猜想与假设]氢氧化钠和氢氧化钙;
[探究与验证]稀盐酸;生成白色沉淀;
[反思与评价]因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠;
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.


科目:初中化学 来源: 题型:选择题
| 主食 | 米饭、馒头 |
| 副食 | 烧鸡块、咸鸭蛋、红烧鱼、鱼香肉丝 |
| 饮料 | 牛奶 |
| 你的补充 |
| A. | 糖醋鱼 | B. | 凉拌黄瓜 | C. | 豆腐 | D. | 蛋糕 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应时间/s | t1 | t2 | t3 | t4 | t5 |
| 生成H2的总质量/g | 0.03 | 0.06 | 0.08 | 0.10 | 0.10 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
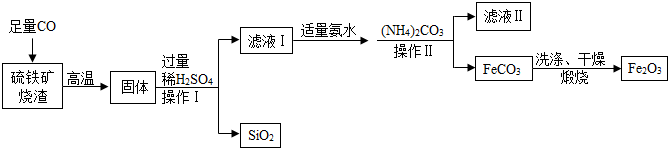
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com