
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:多选题
 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )| A. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| B. | B 点表示盐酸和氢氧化钠恰好完全反应 | |
| C. | C 点时的溶液能使酚酞试液变红 | |
| D. | A 点时,溶液中的溶质有氯化钠和氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
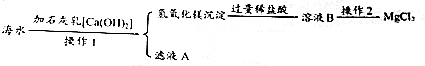
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 缺碘人群食用加碘食盐 | B. | 使用工业酒精勾兑饮用酒 | ||
| C. | 将霉变米淘洗后食用 | D. | 大量使用剧毒农药,杀灭害虫 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
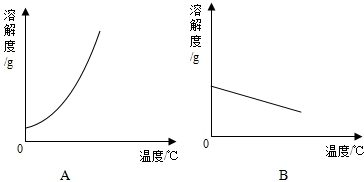
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
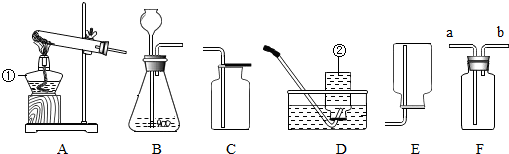
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验操作 | 实验现象 | 实验结论 |
| 用洁净试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡. | 酚酞试液变红色 | 溶液呈碱性 |
| 实验操作 | 实验现象 | 实验结论 |
| 取样品,滴入碳酸钠溶液 | 有气泡产生 | 溶液呈酸性 |
| 取样品,加入锌粒 | 有气泡产生 | |
| 取样品,滴入紫色石蕊 | 溶液变红色 | |
| 取样品,加入氧化铜 | 固体溶解,溶液变蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
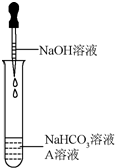 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com