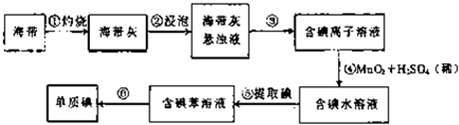
某研究性学习小组设计并进行了如下实验.
(1)甲组同学用图装置制取干燥纯净的二氧化碳气体.请回答下列问题:
①仪器X的名称是
;有孔塑料隔板上的固体物质为
(填名称).
②实验前,关闭活塞,向X中加入水使X中液面高于试管中的液面,一段时间后液面保持不变说明
.
③为除去CO
2中混有的HCl气体,B装置中盛放饱和NaHCO
3溶液,写出该反应的化学方程式:
.要得到干燥的CO
2,C装置应盛放
(填“试剂名称”).
④装置B、C中所装试剂的顺序不可以颠倒,理由是:
.
(2)乙组同学围绕C还原CuO产生的红色固体是否一定是Cu进行探究.
查阅资料:①在空气中高温灼烧时,CuO会分解生成Cu
2O;Cu
2O粉末呈红色,在高温下性质稳定;②Cu
2O在酸性溶液中不稳定,如在稀硫酸中:Cu
2O+H
2SO
4=CuSO
4+Cu+H
2O.
提出猜想:
猜想Ⅰ:红色固体是Cu;
猜想Ⅱ:红色固体是Cu
2O;
猜想Ⅲ:红色固体是
.
实验探究:同学们又分为两组,分别进行以下实验:
①第一组同学取一定质量的红色固体a g,在空气中高温灼烧,直到质量不再发生改变,
称量所得固体质量为b g.并进行数据分析:若a=b,则猜想
成立;
若b>a,则说明红色固体中一定含有
物质.
②第二组同学没有用测量质量的方法也得出了红色固体中含有Cu
2O的结论.该同学设计的实验方法是
.(写出“实验操作、现象和结论”)
解释与结论:根据实验探究,可知C还原CuO时除了发生2CuO+C

2Cu+CO
2↑的反应外,还可能发生的化学反应方程式:
.
拓展延伸:同学们又就Cu
2O是否具有氧化性展开了讨论,请你设计实验方案:
.
实验反思:通过以上实验探究,你对“问题的发现与解决”有何认识?
.


 2Cu+CO2↑的反应外,还可能发生的化学反应方程式: .
2Cu+CO2↑的反应外,还可能发生的化学反应方程式: .
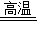 CO2↑+2Cu2O 或5CuO+2C
CO2↑+2Cu2O 或5CuO+2C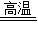 2CO2↑+Cu2O+3 Cu 或 2Cu2O+C
2CO2↑+Cu2O+3 Cu 或 2Cu2O+C 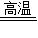 CO2↑+4Cu
CO2↑+4Cu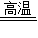 CO2↑+2Cu2O或5CuO+2C
CO2↑+2Cu2O或5CuO+2C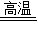 2CO2↑+Cu2O+3 Cu
2CO2↑+Cu2O+3 Cu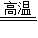 CO2↑+4Cu
CO2↑+4Cu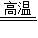 2CO2↑+Cu2O+3 Cu或 2Cu2O+C
2CO2↑+Cu2O+3 Cu或 2Cu2O+C  CO2↑+4Cu等.
CO2↑+4Cu等. 

 名校课堂系列答案
名校课堂系列答案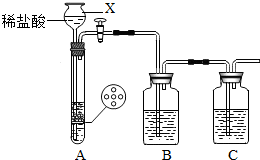 (2012?崇川区一模)某研究性学习小组设计并进行了如下实验.
(2012?崇川区一模)某研究性学习小组设计并进行了如下实验.
 某研究性学习小组设计的实验装置(如图),既可制取气体,又可用于验证物质性质.
某研究性学习小组设计的实验装置(如图),既可制取气体,又可用于验证物质性质.