金属是一类重要的材料,人类的生活和生产都离不开金属.
(1)小琴同学设计如图所示的A、B两个实验.
①在做A,B实验之前,她进行的操作是
用砂纸将铁丝和银丝表面打磨光亮
用砂纸将铁丝和银丝表面打磨光亮
;
②做A实验时,将铁丝和银丝同时插入稀硫酸中所发生反应的化学方程式
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
,其实验目的是
比较铁和银的金属活动性强弱
比较铁和银的金属活动性强弱
;
③B实验中,当烧杯内盛有
CuSO4
CuSO4
溶液时,可验证Fe、
Cu
Cu
、Ag三种金属活动性强弱.
(2)钛合金是21世纪的重要材料,具有熔点高、可塑性好、抗腐蚀性强、与人体有很好的“相容性”等优良性能.金属的下列用途:①用来做保险丝 ②用来制人造骨 ③用于制造船舶 ④用于制造航天飞机.其中与钛合金性能符合的是
②③④
②③④
(填序号).
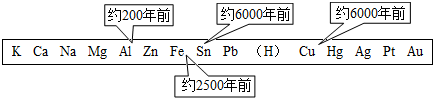
(3)常见的三种金属被发现、使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟下列
③
③
(填序号)选项关系最大.①地壳中金属元素的含量 ②金属的导电性 ③金属活动性
(4)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H
2和FeCl
2发生置换反应,生成“纳米铁”,其化学方程式为
,反应中需要保护气的原因是
防止铁在高温下与氧气反应
防止铁在高温下与氧气反应
.

 金属是一类重要的材料,人类的生活和生产都离不开金属.
金属是一类重要的材料,人类的生活和生产都离不开金属.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案