
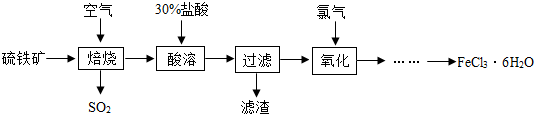
| ||
| ||


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、该气体一定含有H2、CO、CH4 |
| B、该气体可能含有H2和CO |
| C、该气体可能含有CO和CH4 |
| D、该气体可能含有CH4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| 假设(猜想) | 验证方法及操作 | 可能看到的现象 | 结论 |
| 取少量固体滴加 |
是CaCO3和CaO 的混合物 | ||
| 取少量固体滴加 |
只有CaO |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
查看答案和解析>>
科目:初中化学 来源: 题型:
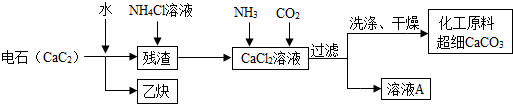
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质用途 | 金刚石切割玻璃 | 石墨作电极 | 活性炭净水 |
| 对应特性 | ① | ② | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com