
| A、溶液中溶质质量增多,溶液的质量减少 |
| B、溶液中溶质质量增多,溶液的质量增加 |
| C、溶液中水的质量减少,溶质质量分数不变 |
| D、溶液中水的质量减少,溶质质量分数增大 |


科目:初中化学 来源: 题型:
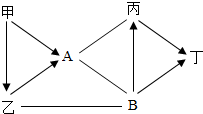 图中都是初中化学常见物质,其中A、B为单质,甲、乙、丙、丁是化合物,甲和乙组成元素相同且通常为液态,丙和丁组成元素相同且通常为气态.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去.
图中都是初中化学常见物质,其中A、B为单质,甲、乙、丙、丁是化合物,甲和乙组成元素相同且通常为液态,丙和丁组成元素相同且通常为气态.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去.查看答案和解析>>
科目:初中化学 来源: 题型:
| A、水量的多少 | B、温度的高低 |
| C、是否搅拌 | D、以上全部 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、与氧化铁反应 |
| B、与盐酸反应 |
| C、与二氧化碳反应 |
| D、与稀硫酸溶液反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、(1)(2)(6)(7) |
| B、(1)(2)(5)(7) |
| C、(3)(4)(5)(7) |
| D、(1)(2)(3)(6) |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
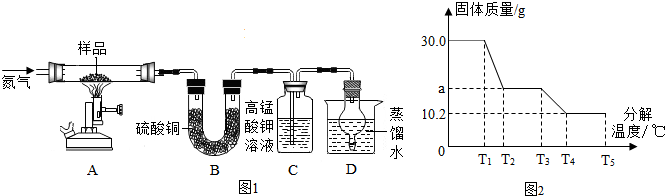
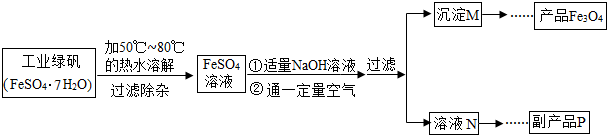
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com