
����Ŀ����ѧʵ���ǿ�ѧ̽������Ҫ;������ش���������:
(1)Ũ�����Ũ���᳨�ڷ��þ����ϡ������Ϊʲô_________?
(2)��ϡ�����ϡ�����ж�����_____________(�ѧ����)�� �����Ǿ������ƵĻ�ѧ����;��Ҳ��Ϊ���ɲ�ͬ�����Ǿ��в�ͬ�Ļ�ѧ���ʣ���ٸ����� ��˵�����Ǿ��в�ͬ�Ļ�ѧ����_____________��
(3)̽��С���ͬѧ������ͼװ����֤ij����������Ƿ���CO2��CO��
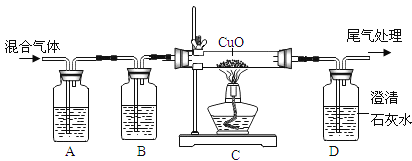
��ABװ����Ӧ�ֱ�ʢ��ʲô�Լ�__________?
����ԭ��������к���CO,�ɹ۲쵽ʲôʵ������__________?
��д��D�п��ܷ�����Ӧ�Ļ�ѧ����ʽ__________��
(4)��ȡ12.5gʯ��ʯ(��Ҫ�ɷ���CaCO3�����ʲ����뷴Ӧ)�����ձ��У������м��� 50gϡ����,����ǡ����ȫ��Ӧ����Ӧ����������ձ���ʣ�����ʵ�������Ϊ58. lg (�������ձ�����������������ܽ�Ⱥ��Բ���)���Լ���ʯ��ʯ�����ʵ���������__________��
���𰸡�Ũ�����лӷ���,���ʵ�������,��Һ��ϡ;Ũ��������ˮ��,�ܼ���������,��Һ��ϡ H+ ��������Ȼ�����Ӧ,���������Ȼ�����Ӧ A:����ʯ��ˮB:����������Һ C�к�ɫ��ĩ���,D�г���ʯ��ˮ����� ![]() 20%
20%
��������
��1��Ũ�����Ũ���᳨�ڷ��þ����ϡ������ΪŨ���������ˮ�ԣ������������䣬�ܼ��������ӣ���������������С��Ũ������лӷ��ԣ������������٣��ܼ��������䣬����������������С��
��2������ˮ��Һ�л����������ӣ���������Ӻͱ����ӻ��������ᱵ�����������Ӻ������ӷ�Ӧ�������Ȼ�������������ϡ�����ϡ�����ж�����H+�������Ǿ������ƵĻ�ѧ���ʣ���Ҳ��Ϊ���ɲ�ͬ�����Ǿ��в�ͬ�Ļ�ѧ���ʣ�˵�����Ǿ��в�ͬ�Ļ�ѧ���ʣ�������Ȼ�����Ӧ���������ᱵ��������������Ȼ�����Ӧ��
��3���ٶ�����̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ��������̼���������Ʒ�Ӧ����̼���ƺ�ˮ������A��Bװ����Ӧ�ֱ�ʢ�ŵ��Լ��dz���ʯ��ˮ������������Һ��
��һ����̼������ͭ�ڼ��ȵ�����������ͭ�Ͷ�����̼��������̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ��������ԭ��������к���CO���ɹ۲쵽��ʵ��������C�к�ɫ������ɫ��D�г���ʯ��ˮ����ǣ�
�۶�����̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ����ѧ����ʽΪ��Ca��OH��2+CO2�TCaCO3��+H2O��
��4�����������غ㶨�ɿ�֪������CO2������Ϊ��12.5g+50 g-58.1g=4.4g��
��ʯ��ʯ��CaCO3������Ϊx��
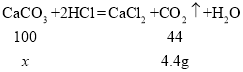
![]()
x=10g��
������Ʒ�����ʵ�������12.5g-10g=2.5g��
ʯ��ʯ�����ʵ���������Ϊ��![]() ��100%=20%��
��100%=20%��


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ���Ʊ��ߴ���Ĺ�������ͼ�������£��Ȼ�þ��Һ�����ԡ�
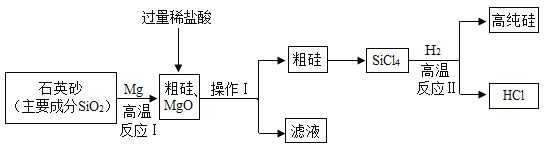
����˵����ȷ����
A.����1Ϊ�����ᾧ
B.�������������У�HCl����ѭ������
C.��ӦI�Ļ�ѧ����ʽ: 2Mg+SiO2=Si+2MgO
D.��Ӧ����Ҫ�����������н��У����Է�ֹ������������϶���ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���ƹ㷺������ֽ����֯��������ϴ�Ӽ����������Ƹ�ȹ�ҵ����һ����Ҫ�Ļ���ԭ�ϡ�������������ά�ͺ�°�Ϊ̼���ƵĹ�ҵ�����������˾��ס�
I������������1789�꣬����ҽ����������N��Leblanc��1742��1806����ʳ�Ρ�Ũ���ᡢľ̿��ʯ��ʯΪԭ�ϣ������˹�ģ����ҵ��ȡ̼���Ƶ��Ⱥӣ�����������ͼ��
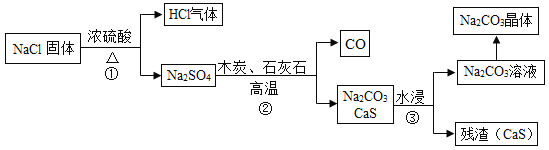
��1��̼�����׳�_____��
��2���ڸ��������£����з���������Ӧ������һ����Na2SO4��ľ̿����Na2S��CO���÷�Ӧ�Ļ�ѧ����ʽΪ_____��
��3�����С�ˮ����ʱͨ����Ҫ���裬��Ŀ����_____��
��4�������п�ѧ�Ҷ������������иĽ�������Ϊ�˷������Բ��㣬��д��һ������֮��_____��
��������ά����1892�꣬����ʱ����ʦ����ά���������̼���ƣ��ֳ�����ά����ԭ�����£�NaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
ij��ȤС���������װ��ģ������ά���Ʊ�̼�����ƣ������Ƶ�̼���ơ�
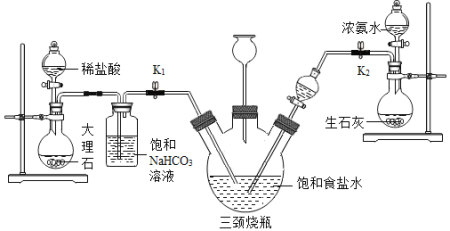
ʵ��������£�
�ٹر�K1����K2ͨ��NH3�������������ʣ������ȶ���K1ͨ��CO2��
�ڴ�������ƿ�ڳ��ֽ϶����ʱ���ر�K2ֹͣͨNH3��һ��ʱ��ر�K1ֹͣͨCO2��
�۽�������ƿ�ڵķ�Ӧ�������ˡ�ϴ�ӡ����¸���������ù�����ȵõ��ϴ���̼���ơ�
��5��װ���б���NaHCO3��Һ�������dz�ȥCO2�л��е�HCl����Ӧ�Ļ�ѧ����ʽΪ_____��
��6��װ����������ƿ�����ӵij���©������Ҫ������_____����ͬѧ��ΪӦ���ڳ���©���ڷ���һ��պ����Һ������������_____
��7��ʵ�������Ũ��ˮ������ʯ���Ͽ��Եõ�����������ԭ����_____��������ȡ�������ŵ���_____��
�����Ƽ���ںܳ�һ��ʱ���ڰѳ���Ӣ�����������������С��ԡ��Ƽ��˰ʵҵ�ȹ���Ϊ�������ҹ���ѧ����ר�Һ�°�������������������ά�����������ڣ�����1943�괴���Եؽ��Ƽ����ư����ֹ�����������������������������ŷţ�ͬʱ������̼���ƺ��Ȼ�����ֲ�Ʒ������������ĺ����Ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͼ�Ǹ�Ԫ�������ڱ��е�һ��
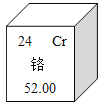
���ܴӸ�ͼ�õ�����Ϣ��:
��1����____________________����____________________��(���)��
��2�����Ļ���������ڼ��˾���Ƿ�ƺ�ݳ�����ԭ��Ϊ�����ƾ�����ɫ��CrO3ת��Ϊ��ɫ��Cr2(SO4)3����CrO3�и�Ԫ�صĻ��ϼ�Ϊ__________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ˮ��˵������ȷ����
A.����ྻ�Ŀ�Ȫˮ�Ǵ�ˮ
B.ˮ���ʱ����������������������Ϊ2: 1
C.ˮ������ϵõ�������
D.ˮ����ʱ�ɳ�����ǣ�˵���¶����߷��ӻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ͬѧ�������ᡢ���������ʵ�ʵ���ϡ���ᡢ����������Һ��̼�����Һ�����һ�𣬹۲쵽�д������ݲ��������ǶԷ�Ӧ����Һ�����ʵijɷָе����沢����ʵ��̽����
���������ϣ�̼�����Һ�ʼ��ԡ�
��������⣩��Ӧ����Һ�����ʵijɷ���ʲô��
���������룩����٣�KCl��K2CO3������ڣ�KCl��HCl������ۣ�KCl������ܣ�KCl��HCl��K2CO3������ݣ�KCl��K2CO3��KOH��
���������У�����Ϊ���������Dz���_____������ţ���������_____��
��ʵ��̽����
ʵ�鲽�� | ʵ������ | ʵ����� |
��ȡ������Ӧ�����Һ���Թ��У������м��������BaCl2��Һ����ַ�Ӧ����� | _____ | ����ڡ��۲����� |
��ȡ��������ϲ���Һ�������еμ���ɫ��̪��Һ | _____ | ����ݳ��� |
����չӦ�ã�
��1��д��ʵ�鲽����з�����Ӧ�Ļ�ѧ����ʽ��_____��
��2����ȷ����ѧ��Ӧ������Һ������ʳɷ�ʱ�����˿����������⣬��Ҫ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����ѧϰ����кͷ�Ӧʵ��ʱ������������̽����
(1)̽����ͼ��ܷ�����Ӧ
��ͬѧ��ʢ������KOH��Һ���Թ��еμ�����ɫ��̪��Һ������������ϡ���ᣬ�۲쵽��Һ��_____ɫ�����ɫ����ͬѧ�ó����ۣ���ͼ��ܷ�����Ӧ����д��ϡ���������������Һ��Ӧ�Ļ�ѧ����ʽ_______��
(2)̽����ͼӦ����Һ�����ʵijɷ�
��ͬѧ��̽��I�м�ͬѧʵ������ɫ��Һչ��̽����
��������⣩�Թ�����ɫ��Һ�����ʳ��˷�̪����ʲô?
��������룩����һ��KCl�� �������KCl��______��
�����ʵ�飩���Թ��м���������������ĩ��Ȼ����������ͬѧʵ������ɫ��Һ��
��������ʽ����ĩ����ʧ����Һ��Ϊ____ɫ����Ӧ�Ļ�ѧ����ʽ��________��
��ʵ����ۣ����������
����ɢ˼ά��Ϊ����֤���������������Ϊ������ѡ���������_____(��ѡ��)��
A Ba(NO3)2 B � C Cu D ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������㳣�� Na2CO3�� NaHCO3 �����ɼ�����У��ѧ��ȤС���ͬѧ���� Na2CO3 �� NaHCO3�����ʽ�����һϵ��̽����
���������ϣ�
(1)�ܽ�ȱȽϣ�
�ܽ�� | 10�� | 20�� | 30�� | 40�� |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(2)��֪̼��������270�����Ҿ��ֽܷ�Ϊ̼���ơ�ˮ�Ͷ�����̼����̼�������Ȳ��ֽ⡣
��̽��һ��NaHCO3 ��Na2CO3 �ܽ�Ȳ����̽����
С��ͬѧ�ֱ�ȡ xg ���ֹ����ĩ���� 20��10 g ˮ�г���ܽ⣬ͨ���۲��������ֳ�̼���ƺ�̼�����ƣ�x ������_________________��
A 2 B 0.96 C 0.5 D 3
��̽�������ⶨij Na2CO3��NaHCO3������� NaHCO3����������
[����һ]��ȡһ��������Ʒ�����������м��������غ���ȴ������ʣ��������������㡣
(1)�����з�����Ӧ�Ļ�ѧ����ʽΪ��_________________��
(2)ʵ���У�����������ص�Ŀ����_________________��
[������]������ͼװ�ý���ʵ�飬װ��B�з�����Ʒ(����װ�����������ã���װ�����������ռ�����)��
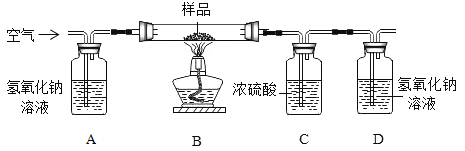
��ʵ�鲽�裩
(1)���װ�õ������ԣ� (2)��ȡ��Ʒ 10 g���ӵ�װ�� B �У� (3)����װ�� B��C��D ������(��ҩƷ)��(4) ����װ�ã� (5)���ȣ�(6)ֹͣ���ȼ���ͨ�������(7)�ٴγ���װ�� B��C��D ������(��ҩƷ)��
�����ݼ�¼��
װ��B | װ��C | װ��D | |
ʵ��ǰ���ʵ�����/g | 180.0 | 200.0 | |
��������ʵ�����/g | 176.9 | 201.5 | 124.8 |
������ش�
����ͼװ�� C ��������_________________��װ�� C ��һ�����ԵĴ�����_________________��
��ʵ������б�����װ����ͨ�������װ�� A �з����Ļ�ѧ����ʽΪ_________________����û��װ�� A����ɲⶨ���_________________ (����ƫ����������������ƫС��)��
�����۷�����
С��ͬѧ��Ϊ���������������ݶ����Լ������Ʒ�� NaHCO3��������������С����Ϊ������ C װ�õ������仯�����㣬��������_________________���Ľ�������_________________��С������Ϊ��װ�� D ���������ƫ���Ӱ����㣬Ӧ����һ��������_________________��Ŀ����_________________��
�����ݴ����������������ۣ����һ����Ӧ�����ñ����е�װ�� B �������仯���м���NaHCO3��Na2CO3�������NaHCO3����������_________________��
����չӦ�ã�����Na2CO3�л�������NaHCO3����ͨ��_________________������ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��M��N�������ʵ��ܽ�����ߡ�
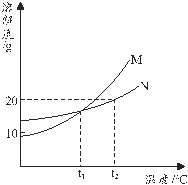
��1����ͼ���Կ�����M��N���������У��ܽ�����¶�Ӱ��ϴ�������� ��
��2��M��N�����ʵ��ܽ�����ʱ���¶��� �档
��3��t2��ʱ������ֻ��ʢ��100 gˮ���ձ��У��ֱ����M��N��20 g����ֽ��裬���¶�ʱ�ܵõ�������Һ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com